Vyondys 53
As Informações Neste Site Não Constituem Aconselhamento Médico. Não Vendemos Nada. A Precisão Da Tradução Não É Garantida. Isenção De Responsabilidade
Resumo das drogas
O que é Vyondys 53?
Vyondys 53 (Golodirsen) é um oligonucleotídeo antisense indicado para o tratamento de Distrofia muscular de Duchenne (DMD) em pacientes que têm uma mutação confirmada do gene DMD que é passível de pular exon 53.
Quais são os efeitos colaterais de Vyondys 53?
Vyondys 53
- urticária
- dificuldade em respirar
- inchaço da língua ou garganta dos lábios do seu rosto
- coceira
- irritação na pele
- Blistering ou descascamento da pele
- urina marrom ou vermelho rosa
- urina espumosa e
- inchando no seu rosto com as mãos ou estômago
Obtenha ajuda médica imediatamente se tiver algum dos sintomas listados acima.
Os efeitos colaterais de Vyondys 53 incluem:
- dor de cabeça
- febre
- cai
- dor abdominal
- escorrendo ou nariz entupido
- tosse
- vomitando
- náusea
- dor no local da administração
- dor nas costas
- diarréia
- tontura
- entorse do ligamento
- contusão
- gripe
- dor na boca e na garganta
- abrasão da pele
- infecção por ouvido
- sazonal alergia
- freqüência cardíaca rápida
- Reação relacionada ao local do cateter
- constipação e
- fratura
Procure cuidados médicos ou ligue para o 911 de uma só vez, se tiver os seguintes efeitos colaterais graves:
- Sintomas graves oculares, como perda súbita de visão de visão, visão de visão da visão ou inchaço ou vendo halos ao redor das luzes;
- Sintomas cardíacos graves, como batimentos cardíacos irregulares ou batendo rápidos; flutuando no seu peito; falta de ar; e tontura repentina Tardete ou desmaiar;
- Confusão de dor de cabeça grave arborizada braço de fala ou fraqueza da perna TROBLEMENTO A perda de coordenação sentindo músculos instáveis muito rígidos, febre alta, sudorese ou tremores.
Este documento não contém todos os efeitos colaterais possíveis e outros podem ocorrer. Verifique com seu médico para obter informações adicionais sobre efeitos colaterais.
Dosagem para Vyondys 53
A dose de Vyondys 53 é de 30 miligramas por quilograma uma vez por semana.
Vyondys 53 em crianças
O Vyondys 53 é indicado para o tratamento da distrofia muscular de Duchenne (DMD) em pacientes que têm uma mutação confirmada do gene DMD que é passível de pular exon 53, incluindo pacientes pediátricos.
Quais drogas substâncias ou suplementos interagem com o Vyondys 53?
Vyondys 53 pode interagir com outros medicamentos.
Diga ao seu médico todos os medicamentos e suplementos que você usa.
Vyondys 53 durante a gravidez e amamentação
Diga ao seu médico se você está grávida ou planeja engravidar antes de usar o Vyondys 53; Não se sabe como isso afetaria um feto. Não se sabe se Vyondys 53 passa para o leite materno. Consulte seu médico antes de amamentar.
Informações adicionais
Nossa injeção de Vyondys 53 (Golodirsen) para uso de medicamentos de efeitos colaterais de uso intravenoso fornece uma visão abrangente das informações disponíveis dos medicamentos sobre os possíveis efeitos colaterais ao tomar este medicamento.
Esta não é uma lista completa de efeitos colaterais e outros podem ocorrer. Ligue para o seu médico para obter conselhos médicos sobre efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Informações sobre medicamentos da FDA
- Descrição do medicamento
- Indicações
- Efeitos colaterais
- Avisos
- Overdose
- Farmacologia Clínica
- Guia de medicação
Descrição para Vyondys 53
A injeção de Vyondys 53 (Golodirsen) é uma solução concentrada sem conservantes aquosa estéril para diluição antes da administração intravenosa. O Vyondys 53 é um líquido incolor claro a ligeiramente opalescente. O Vyondys 53 é fornecido em frascos de dose única contendo 100 mg de Golodirsen (50 mg/ml). O Vyondys 53 é formulado como uma solução salina tamponada com fosfato isotônico com uma osmolaridade de 260 a 320 Mosm e um pH de 7,5. Cada mililitro de Vyondys 53 contém: 50 mg Golodirsen; 0,2 mg de cloreto de potássio; 0,2 mg de fosfato de potássio monobásico; 8 mg de cloreto de sódio; e 1,14 mg de fosfato de sódio anidro em água para injeção. O produto pode conter ácido clorídrico ou hidróxido de sódio para ajustar o pH.
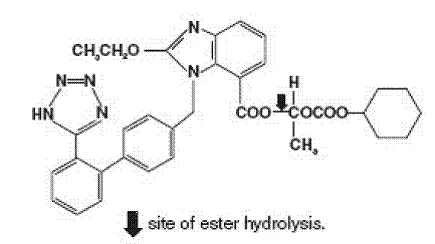
Golodirsen é um oligonucleotídeo antisense do oligômero morfolino de fosforodiamidato (PMO). Os PMOs são moléculas sintéticas nas quais os anéis ribofuranosil de cinco membros encontrados no DNA e RNA naturais são substituídos por um anel morfolino de seis membros. Cada anel morfolino está ligado através de uma porção fosforodiamida não carregada, em vez da ligação de fosfato com carga negativa que está presente no DNA e RNA naturais. Cada subunidade morfolino de fosforodiamidato contém uma das bases heterocíclicas encontradas no DNA (adenina citosina guanina ou timina). Golodirsen contém 25 subunidades vinculadas. A sequência de bases da extremidade 5 'a 3' é GTTGCCCCCGGTTCTGAAGGTGTTC. A fórmula molecular de Golodirsen é C305H481N138O112P25 e o peso molecular é 8647,28 daltons. A estrutura de Golodirsen é:
 |
Usos para Vyondys 53
Vyondys 53 é indicado para o tratamento de Distrofia muscular de Duchenne (DMD) em pacientes que têm uma mutação confirmada do gene DMD que é passível de pular exon 53. This indication is approved under accelerated approval based on an increase in dystrophin production in skeletal muscle observed in patients treated with Vyondys 53 [see Estudos clínicos ]. A aprovação contínua para essa indicação pode depender da verificação de um benefício clínico em ensaios confirmatórios.
Dosagem para Vyondys 53
Monitoramento para avaliar a segurança
A vareta sérica de cistatina C da urina e a proporção de proteína-criatina-criatina devem ser medidas antes de iniciar o Vyondys 53. Considere a medição da taxa de filtração glomerular antes do início do Vyondys 53. Monitoramento quanto à toxicidade renal durante o tratamento é recomendado. Obtenha as amostras de urina antes da infusão de Vyondys 53 ou pelo menos 48 horas após a infusão mais recente [ver Avisos e precauções ].
Informação de dosagem
A dose recomendada de Vyondys 53 é de 30 miligramas por quilograma administrada uma vez por semana como uma infusão intravenosa de 35 a 60 minutos por meio de um filtro de 0,2 mícrons em linha.
Se uma dose de Vyondys 53 for perdida, poderá ser administrada o mais rápido possível após a dose programada.
Instruções de preparação
O Vyondys 53 é fornecido em frascos de dose única como uma solução concentrada livre de conservantes que requer diluição antes da administração. Os medicamentos parenterais devem ser inspecionados visualmente para material particulado e descoloração antes da administração sempre que a licença de solução e contêiner. Use técnica asséptica.
- Calcule a dose total de Vyondys 53 a ser administrada com base no peso do paciente e na dose recomendada de 30 miligramas por quilograma. Determine o volume de Vyondys 53 e o número correto de frascos para fornecer a dose calculada completa.
- Deixe os frascos que aquecem até a temperatura ambiente. Misture o conteúdo de cada frasco invertendo suavemente 2 ou 3 vezes. Não agite.
- Inspecione visualmente cada frasco de Vyondys 53. A solução é um líquido incolor claro e levemente opalescente e pode conter quantidades vestigiais de pequenas partículas amorfas brancas a esbranquiçadas. Não use se a solução nos frascos estiver nublada descolorida ou contiver material de partículas estranhas que não sejam quantidades vestigiais de pequenas partículas amorfas esbranquiçadas.
- Com uma seringa equipada com uma agulha de calibre 21 ou menor de peito, retire o volume calculado de Vyondys 53 do número apropriado de frascos.
- Dilua os vyondys retirados 53 em injeção de cloreto de sódio a 0,9% USP para fazer um volume total de 100 a 150 ml. Inverta suavemente 2 a 3 vezes para misturar. Não agite. Inspecione visualmente a solução diluída. Não use se a solução estiver nublada descolorida ou contém material de partículas estranhas que não sejam quantidades vestigiais de pequenas partículas amorfas esbranquiçadas.
- Administre a solução diluída por meio de um filtro de 0,2 mícrons em linha.
- O Vyondys 53 não contém conservantes e deve ser administrado imediatamente após a diluição. Infusão completa de Vyondys diluídos 53 dentro de 4 horas após a diluição. Se o uso imediato não for possível, o produto diluído pode ser armazenado por até 24 horas a 2 ° C a 8 ° C (36 ° F a 46 ° F). Não congele. Descarte Vyondys não utilizado 53.
Instruções de administração
A aplicação de um creme anestésico tópico no local da infusão antes da administração de Vyondys 53 pode ser considerado.
O Vyondys 53 é administrado por infusão intravenosa. Limite a linha de acesso intravenosa com injeção de cloreto de sódio a 0,9% USP antes e após a infusão.
Infuse o Vyondys diluído 53 acima de 35 a 60 minutos através de um filtro de 0,2 mícrons em linha. Não misture outros medicamentos com o Vyondys 53 ou infundem outros medicamentos concomitantemente através da mesma linha de acesso intravenosa com Vyondys 53.
Se ocorrer uma reação de hipersensibilidade, considere desacelerar a infusão interrompida ou interrompendo a terapia de Vyondys 53 [ver Contra -indicações Avisos e precauções e Reações adversas ].
Como fornecido
Formas e forças de dose
Vyondys 53 é um líquido incolor claro a um pouco opalescente e pode conter quantidades vestígios de pequenas partículas amorfas brancas a esbranquiçadas e disponíveis como:
- Injeção : Solução de 100 mg/2 ml (50 mg/ml) em um frasco de dose única
Vyondys 53 A injeção é fornecida em frascos de dose única. A solução é um líquido incolor claro a ligeiramente opalescente e pode conter quantidades vestigiais de pequenas partículas amorfas brancas a esbranquiçadas.
Frascos de dose única contendo 100 mg/2 ml (50 mg/ml) NDC 60923-465-02
Armazenamento e manuseio
Armazene Vyondys 53 a 2 ° C a 8 ° C (36 ° F a 46 ° F). Não congele. Armazene na caixa original até estar pronto para serem protegidos da luz.
Fabricado para: Sarepta Therapeutics Inc. Cambridge MA 02142 EUA. Revisado: junho de 2024
Efeitos colaterais para Vyondys 53
As seguintes reações adversas graves são descritas abaixo e em outras partes da rotulagem:
- Reações de hipersensibilidade [ver Avisos e precauções ]
Experiência em ensaios clínicos
Como os ensaios clínicos são conduzidos sob condições amplamente variadas, as taxas de reação adversa observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparados às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
No Programa de Desenvolvimento Clínico de Vyondys 53, 58 pacientes receberam pelo menos uma dose intravenosa de Vyondys 53 variando entre 4 mg/kg (0,13 vezes a dosagem recomendada) e 30 mg/kg (a dosagem recomendada). Todos os pacientes eram do sexo masculino e confirmaram geneticamente a distrofia muscular de Duchenne. A idade na entrada do estudo foi de 6 a 13 anos. A maioria dos pacientes (86%) eram caucasianos.
Vyondys 53 was studied in 2 double-blind placebo-controlled studies.
No estudo 1, a parte 1 pacientes foram randomizados para receber infusões intravenosas de Vyondys 53 (n = 8) em quatro níveis crescentes de dose de 4 mg/kg a 30 mg/kg ou placebo (n = 4) por pelo menos 2 semanas em cada nível. Todos os pacientes que participaram do estudo 1 Parte 1 (n = 12) foram continuados no Estudo 1 Parte 2 Uma extensão de etiqueta aberta durante a qual receberam Vyondys 53 na dose de 30 mg/kg IV uma vez por semana [ver semanalmente [ver Estudos clínicos ].
No estudo, 2 pacientes receberam Vyondys 53 (n = 33) 30 mg/kg ou placebo (n = 17) IV uma vez por semana por até 96 semanas após o qual todos os pacientes receberam Vyondys 53 na dose de 30 mg/kg.
As reações adversas observadas em pelo menos 20% dos pacientes tratados nas seções controladas por placebo dos estudos 1 e 2 são mostradas na Tabela 1.
Tabela 1: Reações adversas que ocorreram em pelo menos 20% dos pacientes tratados com 53 tratados com Vyondys e a uma taxa maior que o placebo nos estudos 1 e 2
| Reação adversa | Vyondys 53 (N = 41) % | Placebo (N = 21) % |
| Dor de cabeça | 41 | 10 |
| Pirexia | 41 | 14 |
| Cair | 29 | 19 |
| Dor abdominal | 27 | 10 |
| Nasofaringite | 27 | 14 |
| Tosse | 27 | 19 |
| Vomitando | 27 | 19 |
| Náusea | 20 | 10 |
Outras reações adversas que ocorreram em uma frequência superior a 5% dos pacientes tratados com 53 tratados com Vyondys e em uma frequência maior que o placebo: Administração Dor da dor nas costas Dor da dor na diarréia da diarréia entorse em entalhes de contusão da influenza orofaríngea rinite a abrasão da pele sazonal alergia Taquicardia Cateter Relacionado constipação e fratura.
As reações de hipersensibilidade ocorreram em pacientes tratados com Vyondys 53 [ver Avisos e precauções ].
Efeitos colaterais do letrozol para infertilidade
Experiência de pós -mercado
As seguintes reações adversas foram identificadas durante o uso pós -aprovação de Vyondys 53. Como essas reações são relatadas voluntariamente de uma população de tamanho incerta, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal à exposição a drogas.
Distúrbios do sistema imunológico: Anafilaxia [Veja Contra -indicações e Avisos e precauções ]
Interações medicamentosas para Vyondys 53
Nenhuma informação fornecida
Avisos para Vyondys 53
Incluído como parte do PRECAUÇÕES seção.
Precauções para Vyondys 53
Reações de hipersensibilidade
Reações de hipersensibilidade, incluindo anafilaxia, pirexia pruritus urticária dermatite e esfoliação da pele ocorreram em pacientes tratados com 53 tratados com Vyondys. Se uma reação de hipersensibilidade ocorrer instituir tratamento médico apropriado e considerar desacelerar a interrupção da infusão ou descontinuando a terapia e monitor de Vyondys 53 até que a condição resolva [consulte Dosagem e administração ]. Vyondys 53 is contraindicated in patients with a history of a serious hypersensitivity reaction to golodirsen or to any of the inactive ingredients in Vyondys 53 [see Contra -indicações ].
Toxicidade renal
Toxicidade renal foi observada em animais que receberam Golodirsen [ver Use em populações específicas ]. Although kidney toxicity was not observed in the clinical studies with Vyondys 53 the clinical experience with Vyondys 53 is limited e kidney toxicity including potentially fatal glomerulonephritis has been observed after administration of some antisense oligonucleotides. Kidney function should be monitored in patients taking Vyondys 53. Because of the effect of reduced skeletal muscle mass on creatinine measurements creatinine may not be a reliable measure of kidney function in DMD patients. Serum cystatin C urine dipstick e urine protein-to-creatinine ratio should be measured before starting Vyondys 53. Consider also measuring glomerular filtration rate using an exogenous filtration marker before starting Vyondys 53. During treatment monitor urine dipstick every month e serum cystatin C e urine protein-to-creatinine ratio every three months. Only urine expected to be free of excreted Vyondys 53 should be used for monitoring of urine protein. Urine obtained on the day of Vyondys 53 infusion prior to the infusion or urine obtained at least 48 hours after the most recent infusion may be used. Alternatively use a laboratory test that does not use the reagent pyrogallol red as this reagent has the potential to cross react with any Vyondys 53 that is excreted in the urine e thus lead to a false positive result for urine protein.
Se um aumento persistente na cistatina C ou proteinúria sérico for detectada, consulte um nefrologista pediátrico para avaliação adicional.
Toxicologia não clínica
Carcinogênese mutagênese comprometimento da fertilidade
Carcinogênese
Administração de camundongos Golodirsen para transgênicos masculinos (TG.Rash2) (0 100 300 ou 1000 mg/kg) semanalmente por 26 semanas por injeção subcutânea e ratos machos (0 30 100 ou 300 mg/kg) por semana por até 102 semanas, por injeção intravenosa, resultando em aumento de neoplas.
Mutagênese
Golodirsen foi negativo em ensaios in vitro (mutação reversa bacteriana e aberração cromossômica nas células CHO) e in vivo (micronúcleos de medula óssea de camundongo).
Quanto tempo você pode levar saxenda
Comprometimento da fertilidade
Os estudos de fertilidade em animais não foram conduzidos com Golodirsen. Não foram observados efeitos de Golodirsen no sistema reprodutivo masculino após administração subcutânea semanal (0 120 300 ou 600 mg/kg em camundongos machos ou administração intravenosa semanal (0 80 200 ou 400 mg/kg) para os macacos e a exposição plasmática (aucena), que são mais altos que são testados em machos, que são os que estão a favor de que a exposição de prisões e 400 machos, que são mais altos, a mais de que a prisão e 400 mg/kg) a apropriado e a exposição de prisões que são mais altas e as posições de prisão e 400 mg/kg) para os machos. dose intravenosa de 30 mg/kg.
Use em populações específicas
Gravidez
Resumo do risco
Não há dados humanos ou animais disponíveis para avaliar o uso de Vyondys 53 durante a gravidez. Na população geral dos EUA, os principais defeitos congênitos ocorrem em 2 a 4% e o aborto ocorre em 15 a 20% das gestações clinicamente reconhecidas.
Lactação
Resumo do risco
Não há dados humanos ou animais para avaliar o efeito de Vyondys 53 na produção de leite A presença de Golodirsen no leite ou os efeitos do Vyondys 53 no bebê amamentado.
Os benefícios de desenvolvimento e saúde da amamentação devem ser considerados juntamente com a necessidade clínica da mãe de Vyondys 53 e quaisquer possíveis efeitos adversos no bebê amamentado de Vyondys 53 ou da condição materna subjacente.
Uso pediátrico
Vyondys 53 é indicado para o tratamento de Distrofia muscular de Duchenne (DMD) in patients who have a confirmed mutation of the DMD gene that is amenable to exon 53 skipping including pediatric patients [see Estudos clínicos ].
A administração intravenosa de Golodirsen (0 100 300 ou 900 mg/kg) a ratos masculinos juvenis uma vez por semana durante 10 semanas (dias pós -natais 14 a 77) não resultaram em desenvolvimento pós -natal (por exemplo, função imune neurocorreal ou reprodução masculina). No entanto, na dose mais alta testada (900 mg/kg/semana), Golodirsen resultou na morte de animais por causa de comprometimento ou falha renal. Nos animais sobreviventes (incluindo um animal na dose mais baixa testada), houve um aumento dependente da dose na incidência e gravidade dos efeitos tubulares renais (incluindo a vacuolação e dilatação da fibrose de degeneração/regeneração) que se correlacionaram com alterações nos parâmetros de patologia clínica que refletem uma impressão de dependente da dose da função renal. Além disso, foram observadas diminuições no conteúdo mineral da área óssea e na densidade mineral na dose mais alta testada (900 mg/kg de semana), mas sem efeito no crescimento ósseo. Uma dose sem efeito para toxicidade renal não foi identificada; A dose mais baixa testada (100 mg/kg/semana) foi associada a exposições plasmáticas (AUC) aproximadamente 2,5 vezes a que em humanos na dose humana recomendada de 30 mg/kg/semana.
Uso geriátrico
A DMD é em grande parte uma doença de crianças e adultos jovens; Portanto, não há experiência geriátrica com Vyondys 53.
Pacientes com deficiência renal
A depuração renal de Golodirsen é reduzida em adultos não-DMD com deficiência renal com base na taxa estimada de filtração glomerular calculada usando a modificação da equação da dieta e doenças renais (MDRD) [consulte Farmacologia Clínica ]. However because of the effect of reduced skeletal muscle mass on creatinine measurements in DMD patients no specific dosage adjustment can be recommended for DMD patients with renal impairment based on estimated glomerular filtration rate. Patients with known renal function impairment should be closely monitored during treatment with Vyondys 53.
Overdose Informações para Vyondys 53
Nenhuma informação fornecida
Contra -indicações para Vyondys 53
Vyondys 53 is contraindicated in patients with a serious hypersensitivity reaction to golodirsen or to any of the inactive ingredients in Vyondys 53. Anaphylaxis has occurred in patients receiving Vyondys 53 [see Avisos e precauções ].
Farmacologia Clínica for Vyondys 53
Mecanismo de ação
O Golodirsen foi projetado para se ligar ao exon 53 da distrofina pré-mRNA, resultando em exclusão desse exon durante o processamento do mRNA em pacientes com mutações genéticas que são passíveis de pular exon 53. O pular exon 53 tem como objetivo permitir a produção de uma proteína distrofina truncada internamente truncada em pacientes com mutações genéticas que são passíveis de pular exon 53 [ver [veja Estudos clínicos ].
Farmacodinâmica
Após o tratamento com Vyondys 53 todos os pacientes avaliados (n = 25) no estudo 1 Parte 2 [ver Estudos clínicos ] tiveram um aumento no pulado do exon 53 demonstrado pela reação em cadeia da polimerase de transcrição reversa (RT-PCR) em comparação com a linha de base.
No estudo 1 Parte 2 [ver Estudos clínicos ] Os níveis de distrofina, avaliados pelo ensaio de Sarepta Western blot, aumentaram de 0,10% (DP 0,07) do normal na linha de base para 1,02% (DP 1,03) do normal após 48 semanas de tratamento com Vyondys 53. A mudança média da linha de base na distofina após 48 semanas de tratamento com Vyondys 53 foi 0.92<0.001); the median change from baseline was 0.88%. This increase in dystrophin protein expression positively correlated with the level of exon skipping. Dystrophin levels assessed by western blot can be meaningfully influenced by differences in sample processing analytical technique reference materials e quantitation methodologies. Therefore comparing dystrophin results from different assay protocols will require a steardized reference material e additional bridging studies.
A localização correta da distrofina truncada no sarcolema nas fibras musculares de pacientes tratados com Golodirsen foi demonstrada por coloração com imunofluorescência.
Farmacocinética
A farmacocinética de Golodirsen foi avaliada em pacientes com DMD após administração de doses intravenosas que variam de 4 mg/kg/semana a 30 mg/kg/semana (ou seja, dosagem recomendada). A exposição de Golodirsen aumentou proporcionalmente com a dose com acumulação mínima com dosagem uma vez por semana. A variabilidade entre sujeitos (como% CV) para CMAX e AUC variou de 38% a 72% e 34% a 44%, respectivamente.
Distribuição
O volume de distribuição no estado estacionário foi semelhante entre pacientes com DMD e indivíduos saudáveis. O volume médio de distribuição de Golodirsen foi de 668 ml/kg (%CV = 32,3) na dose de 30 mg/kg. A ligação da proteína plasmática de Golodirsen variou de 33% a 39% e não depende da concentração.
Eliminação
A meia-vida de eliminação de Golodirsen (DP) foi de 3,4 (0,6) horas e a depuração plasmática foi de 346 ml/h/kg na dose de 30 mg/kg.
Metabolismo
Golodirsen é metabolicamente estável. Nenhum metabólito foi detectado no plasma ou na urina.
Excreção
Golodirsen é principalmente excretado inalterado na urina. A meia-vida de eliminação (T½) foi de 3,4 horas.
Populações específicas
Idade
A farmacocinética de Golodirsen foi avaliada em pacientes com DMD pediátrica do sexo masculino. Não há experiência com o uso de Vyondys 53 em pacientes com DMD com 65 anos ou mais.
Sexo
Sexo effects have not been evaluated; Vyondys 53 has not been studied in female patients.
Corrida
O impacto potencial da raça não é conhecido porque 92% dos pacientes em estudos foram caucasianos.
Pacientes com deficiência renal
O efeito do comprometimento renal na farmacocinética do Golodirsen foi avaliado em indivíduos não-DMD com idades entre 41 e 65 anos com doença renal crônica em estágio 2 (DRC) (n = 8 taxa de filtração glomerular estimada (EGFR) ≥60 e <90 mL/min/1.73 m²) or Stage 3 CKD (n=8 eGFR ≥30 e <60 mL/min/1.73 m²) e matched healthy subjects (n=8 eGFR ≥90 mL/min/1.73 m²). Subjects received a single 30 mg/kg IV dose of golodirsen.
Em indivíduos com a exposição do estágio 2 ou do estágio 3 (AUC) (AUC) aumentou aproximadamente 1,2 vezes e 1,9 vezes, respectivamente. Não houve alteração no CMAX em indivíduos com CPK do estágio 2; Nos indivíduos com DRC em estágio 3, houve um aumento de 1,2 vezes no CMAX em comparação com os indivíduos com função renal normal. O efeito da DRC do estágio 4 ou do estágio 5 na farmacocinética e segurança de Golodirsen não foi estudado.
Os valores estimados de TFG derivados das equações de MDRD e das definições de limiar para vários estágios de DRC em adultos saudáveis não seriam generalizáveis para pacientes pediátricos com DMD. Portanto, nenhum ajuste específico de dose pode ser recomendado para pacientes com deficiência renal [ver Use em populações específicas ].
Pacientes com comprometimento hepático:
Vyondys 53 has not been studied in patients with hepatic impairment.
Estudos de interação medicamentosa
Golodirsen não inibiu o CYP1A2 CYP2B6 CYP2C8 CYP2C9 CYP2C19 CYP2D6 ou CYP3A4/5 in vitro. Golodirsen era um indutor fraco do CYP1A2 e não induziu CYP2B6 ou CYP3A4. Golodirsen não foi metabolizado por microssomas hepáticos humanos e não era um substrato ou inibidor forte de nenhum dos principais transportadores de drogas humanas testadas (OAT1 OAT3 OCT2 OATP1B1 Mate1 P-gp BCRP e MRP2 OATP1B3 e Mate2-K). Com base em dados in vitro, o Golodirsen tem um baixo potencial para interações medicamentosas em medicamentos em humanos.
Toxicologia Animal e/ou Farmacologia
A toxicidade renal foi observada em estudos em camundongos e ratos machos; Os achados da bexiga urinária foram observados em camundongos machos.
Em camundongos machos, Golodirsen foi administrado semanalmente por 12 semanas por injeção intravenosa (0 12 120 ou 960 mg/kg) ou por 26 semanas por injeção subcutânea (0 120 300 ou 600 mg/kg). Nos achados microscópicos de 12 semanas, os achados em renação (dilatação tubular, os elencos basofílicos ou eosinofílicos, a vacuolação) correlacionaram-se com aumentos nos marcadores séricos da função renal (por exemplo, uréia A creatinina de nitrogênio) foi observada principalmente na dose mais alta testada; A hipertrofia do epitélio de transição do ureter ou bexiga urinária foi observada em todas as doses. No estudo de 26 semanas, foram observados degeneração tubular renal e degeneração do epitélio de transição da bexiga urinária em todas as doses.
Em ratos machos, a administração intravenosa de Golodirsen (0 60 100 300 ou 600 mg/kg) semanalmente por 13 semanas resultou em degeneração tubular, exceto na dose mais baixa testada; Na dose alta, as alterações microscópicas foram acompanhadas por aumentos no nitrogênio da uréia sérica.
Em macacos machos, administração intravenosa de Golodirsen (0 80 200 ou 400 mg/kg) por semana por 39 semanas resultou em alterações microscópicas na dilatação renal (Basofilia ou infiltração de células mononucleares) em todas as doses que se correlacionaram com os aumentos nos marcadores séricos da função renal (Urea Nitrogenina Creatinina) e correlacionou -se com os marcadores séricos da função renal (Urea Nitrogenina), a correlacionada com os marcadores séricos da função renal.
Estudos clínicos
O efeito de Vyondys 53 na produção de distrofina foi avaliado em um estudo em pacientes com DMD com uma mutação confirmada do gene DMD que é passível de pular exon 53 (Estudo 1; NCT02310906).
O estudo 1 da parte 1 foi um estudo de titratação de dose com dupla ocultação em 12 pacientes com DMD. Os pacientes foram randomizados 2: 1 para receber Vyondys 53 ou placebo correspondente. Os pacientes tratados com Vyondys 53 receberam quatro níveis crescentes de dose variando de 4 mg/kg/semana (menos que a dosagem recomendada) a 30 mg/kg/semana por infusão intravenosa por 2 semanas em cada nível de dose.
O Estudo 1 Parte 2 foi um estudo aberto de 168 semanas, avaliando a eficácia e a segurança de Vyondys 53 na dose de 30 mg/kg/semana nos 12 pacientes incluídos na Parte 1 mais 13 pacientes adicionais no tratamento com dmd passível de pular exon 53. Na entrada do estudo (na parte 1 ou na parte 2), os pacientes tiveram uma idade média de 8 anos e estavam em uma dose estável de corticosteróides por pelo menos 6 meses. A eficácia foi avaliada com base na mudança da linha de base no nível da proteína de distrofina (medida como % do nível de distrofina em indivíduos saudáveis, isto é, % do normal) na semana 48 da Parte 2. As biópsias musculares foram obtidas em linha de base antes do tratamento e na semana 48 da Parte 2 em todos os vyondys 53 pacientes (N = 25) e foram analisados. Os níveis médios de distrofina aumentaram de 0,10% (DP 0,07) do normal na linha de base para 1,02% (DP 1,03) do normal na semana 48 do estudo 1 Parte 2 com uma alteração média na distrofina de 0,92% (DP 1,01) dos níveis normais (P<0.001); the median change from baseline was 0.88%.
Os níveis individuais de distrofina do paciente do Estudo 1 são mostrados na Tabela 2.
Tabela 2: Expressão da distrofina Sarepta Western blot por paciente individual do Estudo 1
| Número do paciente | Sarepta western blot % distrofina normal | Número do paciente | Sarepta western blot % distrofina normal | ||||
| Linha de base | Parte 2 semana 48 | Mudança da linha de base | Linha de base | Parte 2 semana 48 | Mudança da linha de base | ||
| 1 | 0.08 | 0.09 | 0.01 | 14 | 0.22 | 0.28 | 0.06 |
| 2 | 0.11 | 0.11 | 0.01 | 15 | 0.14 | 0.21 | 0.07 |
| 3 | 0.21 | 0.22 | 0.01 | 16 | 0.05 | 0.42 | 0.37 |
| 4 | 0.05 | 0.12 | 0.08 | 17 | 0.07 | 1.03 | 0.97 |
| 5 | 0.03 | 0.12 | 0.09 | 18 | 0.02 | 1.57 | 1.55 |
| 6 | 0.06 | 0.14 | 0.09 | 19 | 0.12 | 1.17 | 1.05 |
| 7 | 0.12 | 0.37 | 0.25 | 20 | 0.03 | 1.72 | 1.69 |
| 8 | 0.11 | 1.06 | 0.95 | 21 | 0.11 | 1.77 | 1.66 |
| 9 | 0.06 | 0.54 | 0.48 | 22 | 0.31 | 4.30 | 3.99 |
| 10 | 0.05 | 0.97 | 0.92 | 23 | 0.11 | 0.36 | 0.25 |
| 11 | 0.06 | 1.55 | 1.49 | 24 | 0.03 | 0.91 | 0.88 |
| 12 | 0.07 | 1.91 | 1.84 | 25 | 0.07 | 1.29 | 1.22 |
| 13 | 0.10 | 3.25 | 3.15 |
Informações do paciente para Vyondys 53
Reações de hipersensibilidade
Aconselhar pacientes e/ou cuidadores que reações de hipersensibilidade, incluindo anafilaxia, pirexia pruritus urticária e esfoliação da pele ocorreram em pacientes que foram tratados com Vyondys 53. Instrua -os a procurar cuidados médicos imediatos, caso experimentem sinais e sintomas de hipernsibilidade [consulte consulte [veja Avisos e precauções ].
Toxicidade renal
Informar os pacientes que a nefrotoxicidade ocorreu com medicamentos semelhantes aos Vyondys 53. Aconselhar os pacientes sobre a importância do monitoramento da toxicidade renal por seus profissionais de saúde durante o tratamento com Vyondys 53 [ver Avisos e precauções ].