Dupixent
As Informações Neste Site Não Constituem Aconselhamento Médico. Não Vendemos Nada. A Precisão Da Tradução Não É Garantida. Isenção De Responsabilidade
Resumo das drogas
O que é dupixent?
O dupixent (dupilumab) é um antagonista alfa do receptor de interleucina-4 indicado para o tratamento de pacientes adultos e pediátricos com 6 meses ou mais com dermatite atópica moderada a grave (DA) cuja doença não é adequadamente controlada com terapias de prescrição tópica ou quando as terapias não são advientes; Como tratamento de manutenção adicional de pacientes adultos e pediátricos com 6 anos ou mais com asma moderada a grave caracterizada por um fenótipo eosinofílico ou com asma dependente de corticosteróide oral; como tratamento de manutenção adicional em pacientes adultos e pediátricos com 12 anos ou mais de rinossinusite crônica controlada inadequadamente com pólipos nasais (CRWNP); Para o tratamento de pacientes adultos e pediátricos com 1 ano ou mais, pesando pelo menos 15 kg com esofagite eosinofílica (EOE); para o tratamento de pacientes adultos com prurigo nodularis (PN); como tratamento de manutenção adicional de pacientes adultos com doença pulmonar obstrutiva crônica controlada inadequadamente controlada (DPOC) e um fenótipo eosinofílico; e para o tratamento de pacientes adultos e pediátricos com 12 anos ou mais com urticária espontânea crônica (CSU) que permanecem sintomáticas apesar do tratamento anti -histamínico de H1.
Quais são os efeitos colaterais do dupixent?
Os efeitos colaterais do dupixent incluem:
- Reações do local da injeção
- conjuntivite (olho rosa)
- Inflamação da pálpebra
- herpes orais e outros herpes simplex vírus infecção
- Inflamação da córnea (ceratite)
- olho coceira
- olho seco
- eosinofilia
- dor na boca e na garganta
- insônia
- dor de dente
- gastrite
- dor nas articulações
- infecções do trato respiratório superior
- nariz escorrendo/abafado
- tontura
- dor muscular
- diarréia
- infecção viral
- dor de cabeça
- Infecção do trato urinário (UTI)
Procure cuidados médicos ou ligue para o 911 de uma só vez, se tiver os seguintes efeitos colaterais graves:
- Sintomas graves oculares, como perda súbita de visão de visão, visão de visão da visão ou inchaço ou vendo halos ao redor das luzes;
- Sintomas cardíacos graves, como batimentos cardíacos irregulares ou batendo rápidos; flutuando no seu peito; falta de ar; e tontura repentina tontura tontura ou desmaiando;
- Confusão de dor de cabeça grave arborizada braço de fala ou fraqueza da perna TROBLEMENTO A perda de coordenação sentindo músculos instáveis muito rígidos, febre alta, sudorese ou tremores.
Este documento não contém todos os efeitos colaterais possíveis e outros podem ocorrer. Verifique com seu médico para obter informações adicionais sobre efeitos colaterais.
O que é tobradex gotas usadas para
Dose para dupixent
A dosagem adulta recomendada de dupixent para tratar a dermatite atópica é uma dose inicial de 600 mg (duas injeções de 300 mg), seguida de 300 mg dada a cada 2 semanas.
A dose recomendada de dupixent em pacientes pediátricos de 6 meses a 5 anos de idade, pesando 5 a menos de 15 kg, para tratar a dermatite atópica é de 200 mg (uma injeção de 200 mg) a cada 4 semanas. A dose recomendada de dupixent em pacientes pediátricos de 6 meses a 5 anos de idade, com peso de 15 a menos de 30 kg para tratar a dermatite atópica é de 300 mg (uma injeção de 300 mg) a cada 4 semanas.
A dose recomendada de dupixent em pacientes pediátricos de 6 anos a 17 anos de idade, com peso de 15 a menos de 30 kg para tratar a dermatite atópica é de 600 mg (duas injeções de 300 mg) 300 mg. A dose recomendada de dupixent em pacientes pediátricos de 6 anos a 17 anos de idade, com peso de 30 a menos de 60 kg para tratar a dermatite atópica é de 400 mg (duas injeções de 200 mg) 200 mg. A dose recomendada de dupixent em pacientes pediátricos de 6 anos a 17 anos de idade, pesando 60 kg ou mais, para tratar a dermatite atópica é de 600 mg (duas injeções de 300 mg) 300 mg.
A dose recomendada de dupixent em pacientes adultos e pediátricos com 12 anos ou mais para tratar asma é uma dose inicial de carga de 400 mg (duas injeções de 200 mg) e uma dosagem subsequente de 200 mg a cada 2 semanas ou 600 mg (duas injeções de 300 mg) 300 mg a cada 2 semanas.
A dose recomendada de dupixent em pacientes pediátricos de 6 a 11 anos de idade, com peso de 15 a menos de 30 kg para tratar asma, é de 300 mg a cada 4 semanas. A dose recomendada de dupixent em pacientes pediátricos de 6 a 11 anos de idade, pesando 30 kg ou mais, para tratar asma, é de 200 mg a cada 2 semanas.
A dosagem recomendada de dupixent para pacientes adultos e pediátricos com 12 anos de idade ou mais para tratar a rinossinusite crônica com pólipos nasais é de 300 mg dada a cada 2 semanas.
A dosagem adulta recomendada do dupixent para tratar o prurigo nodularis é uma dose inicial de 600 mg (duas injeções de 300 mg), seguida de 300 mg dada a cada 2 semanas.
A dosagem adulta recomendada do dupixent para tratar a doença pulmonar obstrutiva crônica (DPOC) é de 300 mg dada a cada 2 semanas.
A dosagem adulta recomendada de dupixent para tratar a urticária espontânea crônica é uma dose inicial de 600 mg (duas injeções de 300 mg), seguida de 300 mg dada a cada 2 semanas.
A dose recomendada de dupixent em pacientes pediátricos de 12 a 17 anos de idade, com peso de 30 a menos de 60 kg, é de 400 mg (duas injeções de 200 mg) com doses subsequentes de 200 mg a cada 2 semanas. A dose recomendada de dupixent em pacientes pediátricos de 12 a 17 anos de idade, com peso de 60 kg ou mais, é de 600 mg (duas injeções de 300 mg) com doses subsequentes de 300 mg a cada 2 semanas.
Dupixent em crianças
A segurança e a eficácia do dupixent foram estabelecidas em pacientes pediátricos com 6 meses de idade ou mais com dermatite atópica moderada a grave (DA), cuja doença não é adequadamente controlada com terapias de prescrição tópica ou quando essas terapias não são aconselháveis.
A segurança e a eficácia do dupixent em pacientes pediátricos com menos de 6 meses de idade com DA não foram estabelecidos.
A segurança e a eficácia do dupixent para um tratamento de manutenção adicional em pacientes com asma moderada a grave caracterizada por um fenótipo eosinofílico ou com asma dependente de corticosteróide oral foram estabelecidos em pacientes pediátricos com 6 anos de idade e mais.
Segurança e eficácia do dupixent em pacientes pediátricos com menos de 6 anos de idade com asma não foram estabelecidos.
A segurança e a eficácia do dupixent para tratamento de manutenção adicional em pacientes com rinossinusite crônica controlada inadequadamente com pólipos nasais (CRSWNP) foram estabelecidos em pacientes pediátricos com 12 anos ou mais.
A segurança e a eficácia do dupixent em pacientes pediátricos com menos de 12 anos de idade com CRSWNP não foram estabelecidos.
A segurança e a eficácia do dupixent para o tratamento da esofagite eosinofílica (EOE) foram estabelecidas em indivíduos pediátricos com 1 ano de idade e mais com peso pesando pelo menos 15 kg.
A segurança e a eficácia do dupixent em pacientes pediátricos com menos de 1 ano de idade ou pesando menos de 15 kg com EOE não foram estabelecidos.
A segurança e a eficácia do dupixent em pacientes pediátricos com menos de 18 anos de idade com prurigo nodularis (PN) não foram estabelecidos.
A segurança e a eficácia do dupixent em pacientes pediátricos com menos de 18 anos de idade com doença pulmonar obstrutiva crônica (DPOC) não foram estabelecidas. A DPOC é em grande parte uma doença de pacientes adultos.
A segurança e a eficácia do dupixent para o tratamento da urticária espontânea crônica (CSU) em pacientes que permanecem sintomáticos, apesar do tratamento anti -histamínico de H1, foram estabelecidos em pacientes pediátricos com 12 anos de idade ou mais.
A segurança e a eficácia do dupixent em pacientes pediátricos com menos de 12 anos de idade e/ou pesando menos de 30 kg com CSU não foram estabelecidos.
Quais medicamentos substâncias ou suplementos interagem com dupixent?
O Dupixent pode interagir com outros medicamentos, como vacinas vivas.
Diga ao seu médico todos os medicamentos e suplementos que você usa e todas as vacinas que você recebeu recentemente ou planeja obter.
Dupixent durante a gravidez e amamentação
Diga ao seu médico se você está grávida ou planeja engravidar antes de usar o dupixent; Não se sabe se isso afetaria um feto. Há um registro de exposição à gravidez que monitora os resultados da gravidez em pacientes expostos a dupixent durante a gravidez. Não se sabe se o dupixent passar para o leite materno. Sabe -se que a IgG materna passa para o leite materno. Consulte seu médico antes de amamentar.
Informações adicionais
Nossa injeção de dupixent (dupilumab) para uso subcutâneo de efeitos colaterais do uso fornece uma visão abrangente das informações disponíveis dos medicamentos sobre os possíveis efeitos colaterais ao tomar este medicamento.
Esta não é uma lista completa de efeitos colaterais e outros podem ocorrer. Ligue para o seu médico para obter conselhos médicos sobre efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Fonte:
Descrição para dupixent
Dupilumab Um antagonista alfa do receptor interleucina-4 é um anticorpo monoclonal humano da subclasse IgG4 que se liga à subunidade IL-4Rα e inibe a sinalização de IL-4 e IL-13. O dupilumab tem um peso molecular aproximado de 147 kDa.
O dupilumab é produzido pela tecnologia de DNA recombinante na cultura de suspensão de células do ovário de hamster chinês.
A injeção de dupixent (dupilumab) é fornecida como uma solução estéril livre de conservantes, clara a um pouco opalescente, solo amarelo pálido para injeção subcutânea. O Dupixent é fornecido como uma seringa pré-cheia de dose única com blindagem de agulha em uma seringa de vidro transparente de 2,25 ml de siliconizado tipo 1. A tampa da agulha não é feita com látex de borracha natural. Cada seringa pré-cheia fornece 300 mg de dupilumab em 2 ml, que também contém cloridrato de L-arginina (10,5 mg) L- Histidina (6,2 mg) polissorbato 80 (4 mg) aceitato de sódio (2 mg) sacarose (100 mg) e água para injeção pH 5.9.
Usos para dupixent
Dermatite atópica
O dupixent é indicado para o tratamento de pacientes adultos e pediátricos com 6 meses ou mais com dermatite atópica moderada a grave (DA), cuja doença não é adequadamente controlada com terapias de prescrição tópica ou quando essas terapias não são aconselháveis. O dupixent pode ser usado com ou sem corticosteróides tópicos.
Asma
O dupixent é indicado como um tratamento de manutenção adicional de pacientes adultos e pediátricos com 6 anos ou mais com asma moderada a grave caracterizada por um fenótipo eosinofílico ou com asma dependente de corticosteróide oral [ver [ver Estudos clínicos ].
Limitações de uso
O dupixent não é indicado para o alívio do broncoespasmo agudo ou do status asmaticus.
Rinossinusite crônica com pólipos nasais
O Dupixent é indicado como um tratamento de manutenção adicional em pacientes adultos e pediátricos com 12 anos ou mais com rinossinusite crônica controlada inadequadamente com pólipos nasais (CRWNP).
Esofagite eosinofílica
O dupixent é indicado para o tratamento de pacientes adultos e pediátricos com 1 ano e mais de pesos pelo menos 15 kg com esofagite eosinofílica (EOE).
Prurigo nodularis
O dupixent é indicado para o tratamento de pacientes adultos com prurigo nodularis (PN).
Doença pulmonar obstrutiva crônica
O dupixent é indicado como um tratamento de manutenção adicional de pacientes adultos com doença pulmonar obstrutiva crônica controlada inadequadamente controlada (DPOC) e um fenótipo eosinofílico.
Limitações de uso
O dupixent não é indicado para o alívio do broncoespasmo agudo.
Urticária espontânea crônica
O dupixent é indicado para o tratamento de pacientes adultos e pediátricos com 12 anos ou mais com urticária espontânea crônica (CSU) que permanecem sintomáticas apesar do tratamento anti -histamínico de H1.
Limitações de uso
O dupixent não é indicado para o tratamento de outras formas de urticária.
Dose para dupixent
Instruções de administração importantes
O dupixent é administrado por injeção subcutânea.
O Dupixent destina -se ao uso sob a orientação de um profissional de saúde. Forneça treinamento adequado aos pacientes e/ou cuidadores na preparação e administração de dupixent antes do uso de acordo com as instruções de uso.
Uso de caneta pré-cheia ou seringa pré-cheia
A caneta pré-preenchida dupixent é para uso em pacientes adultos e pediátricos com 2 anos ou mais.
A seringa pré-cheia de dupixent é para uso em pacientes adultos e pediátricos com 6 meses ou mais.
Um cuidador ou paciente com 12 anos de idade ou mais pode injetar dupixent usando a seringa pré-cheia ou a caneta pré-cheia. Em pacientes pediátricos de 12 a 17 anos, administre dupixent sob a supervisão de um adulto. Em pacientes pediátricos de 6 meses a menos de 12 anos, administre dupixent por um cuidador.
Instruções de administração
Para pacientes com PN e CSU ad asma, tomando uma dose inicial de 600 mg, administre cada uma das duas injeções de dupixent 300 mg em diferentes locais de injeção.
Para pacientes com asma e CSU, tomando uma dose inicial de 400 mg, administre cada uma das duas injeções de 200 mg de dupixent em diferentes locais de injeção.
Administre injeção subcutânea na coxa ou abdômen, exceto as 2 polegadas (5 cm) ao redor do umbigo. O braço também pode ser usado se um cuidador administrar a injeção.
Gire o local da injeção com cada injeção. Não injete o dupixent na pele que seja macia e machucada ou marcada.
As instruções Dupixent para uso contêm instruções mais detalhadas sobre a preparação e administração de dupixent [ver Instruções para uso ].
Vacinação antes do tratamento
Considere concluir todas as vacinas apropriadas para a idade, conforme recomendado pelas diretrizes atuais de imunização antes de iniciar o tratamento com dupixent [ver Avisos e precauções ].
Dosagem recomendada para dermatite atópica
Dosagem In Adults
A dosagem recomendada de dupixent para pacientes adultos é uma dose inicial de 600 mg (duas injeções de 300 mg), seguida de 300 mg dada a cada 2 semanas (Q2W).
Dosagem In Pacientes pediátricos 6 Months To 5 Years Of Idade
A dosagem recomendada de dupixent para pacientes pediátricos de 6 meses a 5 anos de idade é especificada na Tabela 1.
Tabela 1: dosagem de dupixent em pacientes pediátricos de 6 meses a 5 anos com dermatite atópica
| Peso corporal | Iniciala e dose subsequente |
| 5 a menos de 15 kg | 200 mg (uma injeção de 200 mg) a cada 4 semanas (Q4W) |
| 15 a menos de 30 kg | 300 mg (uma injeção de 300 mg) a cada 4 semanas (Q4W) |
| a Para pacientes pediátricos de 6 meses a 5 anos de idade, com a DA Nenhuma dose de carregamento inicial é recomendada. |
Dosagem In Pacientes pediátricos 6 Years To 17 Years Of Idade
A dosagem recomendada de dupixent para pacientes pediátricos de 6 anos a 17 anos é especificada na Tabela 2.
Tabela 2: Dosagem de dupixent em pacientes pediátricos 6 anos a 17 anos com dermatite atópica
| Peso corporal | Inicial Loading Dose | Dosagem subsequente |
| 15 a menos de 30 kg | 600 mg (duas injeções de 300 mg) | 300 mg a cada 4 semanas (Q4W) |
| 30 a menos de 60 kg | 400 mg (duas injeções de 200 mg) | 200 mg a cada 2 semanas (Q2W) |
| 60 kg ou mais | 600 mg (duas injeções de 300 mg) | 300 mg a cada 2 semanas (Q2W) |
Terapias tópicas concomitantes
O dupixent pode ser usado com ou sem corticosteróides tópicos. Os inibidores tópicos de calcineurina podem ser usados, mas devem ser reservados para áreas problemáticas apenas, como as áreas intertiginosas e genitais do pescoço.
Dosagem recomendada para asma
Dosagem In Adult And Pacientes pediátricos 12 Years And Older
A dosagem recomendada de dupixent para pacientes adultos e pediátricos com 12 anos de idade ou mais é especificada na Tabela 3.
Tabela 3: dosagem de dupixent em pacientes adultos e pediátricos com 12 anos ou mais com asma
| Inicial Loading Dose | Dosagem subsequente |
| 400 mg (duas injeções de 200 mg) | 200 mg a cada 2 semanas (Q2W) |
| Ou | |
| 600 mg (duas injeções de 300 mg) | 300 mg a cada 2 semanas (Q2W) |
| Dosagem for patients with oral corticosteroid-dependent asthma or with co-morbid moderate-to-severe atopic dermatitis or adults with co-morbid chronic rhinosinusitis with nasal polyps | |
| 600 mg (duas injeções de 300 mg) | 300 mg a cada 2 semanas (Q2W) |
Dosagem In Pacientes pediátricos 6 To 11 Years Of Idade
A dosagem recomendada de dupixent para pacientes pediátricos de 6 a 11 anos de idade é especificada na Tabela 4.
Tabela 4: dosagem de dupixent em pacientes pediátricos 6 a 11 anos de idade com asma
| Peso corporal | Iniciala e dose subsequente |
| 15 a menos de 30 kg | 300 mg a cada 4 semanas (Q4W) |
| ≥30 kg | 200 mg a cada 2 semanas (Q2W) |
| a Para pacientes pediátricos de 6 a 11 anos de idade com asma, recomenda -se a dose inicial de carga. |
Para pacientes pediátricos de 6 a 11 anos de idade com asma e anúncio moderado a grave, siga a dosagem recomendada de acordo com a Tabela 2, que inclui uma dose inicial de carga [ver [veja Dosagem e administração ].
Dosagem recomendada para rinossinusite crônica com pólipos nasais
A dosagem recomendada de dupixent para pacientes adultos e pediátricos com 12 anos de idade ou mais é de 300 mg a cada 2 semanas (Q2W).
Dosagem recomendada para esofagite eosinofílica
A dosagem recomendada de dupixent para pacientes adultos e pediátricos com 1 ano de idade e mais de pesagem de pelo menos 15 kg é especificada na Tabela 5.
Tabela 5: Dosagem de dupixent em pacientes adultos e pediátricos 1 ano de idade ou mais com eosinofílica esofagite
| Peso corporal | Dosagem recomendada |
| 15 a menos de 30 kg | 200 mg a cada 2 semanas (Q2W) |
| 30 a menos de 40 kg | 300 mg a cada 2 semanas (Q2W) |
| 40 kg ou mais | 300 mg toda semana (qw) |
Dosagem recomendada For Prurigo nodularis
A dosagem recomendada de dupixent para pacientes adultos é uma dose inicial de 600 mg (duas injeções de 300 mg), seguida de 300 mg dada a cada 2 semanas (Q2W).
Dosagem recomendada For Doença pulmonar obstrutiva crônica
A dose recomendada de dupixent para pacientes adultos é de 300 mg, dados a cada 2 semanas (Q2W).
Dosagem recomendada For Urticária espontânea crônica
Dosagem In Adults
A dosagem recomendada de dupixent para pacientes adultos é uma dose inicial de 600 mg (duas injeções de 300 mg), seguida de 300 mg dada a cada 2 semanas (Q2W).
Dosagem In Pacientes pediátricos 12 To 17 Years Of Idade
A dosagem recomendada de dupixent para pacientes pediátricos de 12 a 17 anos de idade é especificada na Tabela 6.
Tabela 6: dosagem de dupixent em pacientes pediátricos de 12 a 17 anos de idade com CSU
| Peso corporal | Inicial Loading Dose | Dosagem subsequente |
| 30 a menos de 60 kg | 400 mg (duas injeções de 200 mg) | 200 mg a cada 2 semanas (Q2W) |
| 60 kg ou mais | 600 mg (duas injeções de 300 mg) | 300 mg a cada 2 semanas (Q2W) |
Doses perdidas
Se uma dose semanal for perdida, administre a dose o mais rápido possível e inicie uma nova programação semanal a partir da data da última dose administrada.
Se uma dose a cada 2 semanas for perdida, administre a injeção dentro de 7 dias após a dose perdida e retome o cronograma original do paciente. Se a dose perdida não for administrada dentro de 7 dias, aguarde até a próxima dose no cronograma original.
Se uma dose a cada 4 semanas for perdida, administre a injeção dentro de 7 dias após a dose perdida e retome o cronograma original do paciente. Se a dose perdida não for administrada dentro de 7 dias, administre a dose iniciando um novo cronograma com base nesta data.
Preparação para uso
Antes da injeção, remova o dupixent da geladeira e permita que o dupixent atinja a temperatura ambiente (45 minutos para a seringa pré-preenchida de 300 mg/2 ml ou uma caneta pré-preenchida e 30 minutos para a seringa pré-cheia de 200 mg/1,14 ml ou uma caneta pré-cheia) sem remover a tampa da agulha. Após a remoção do dupixent da geladeira, deve ser usada dentro de 14 dias ou descartada.
Inspecione o dupixent visualmente para participar de matéria e descoloração antes da administração. O Dupixent é uma solução clara a ligeiramente opalntecente a amarelo pálido. Não use se o líquido contiver material particulado visível estiver descolorido ou nublado (além de claro a um pouco opalescente incolor a amarelo pálido). O Dupixent não contém conservantes; Portanto, descarte qualquer produto não utilizado restante na seringa pré-cheia ou na caneta pré-cheia.
Como fornecido
Dosagem Forms And Strengths
Dupixent é uma solução clara a ligeiramente opalescente a amarelo pálido em A:
Seringa pré-cheia de dose única com blindagem de agulha como:
- Injeção : 300 mg/2 ml
- Injeção : 200 mg/1,14 ml
Caneta pré-cheia de dose única como:
- Injeção : 300 mg/2 ml
- Injeção : 200 mg/1,14 ml
Dupixent (dupilumab) A injeção é uma solução clara a levemente opalescente e amarela pálida fornecida em seringas pré-cheias de dose única com blindagem de agulha ou canetas pré-cheias.
A seringa pré-cheia com blindagem de agulha foi projetada para entregar:
300 mg de dupixent em solução de 2 ml ( NDC 0024-5914-00)
200 mg de dupixent em solução de 1,14 ml ( NDC 0024-5918-00)
A caneta pré-cheia foi projetada para entregar:
300 mg de dupixent em solução de 2 ml ( NDC 0024-5915-00)
200 mg de dupixent em solução de 1,14 ml ( NDC 0024-5919-00)
Dupixent está disponível em caixas contendo 2 seringas pré-cheias com blindagem de agulha ou 2 canetas pré-cheias.
| Tamanho do pacote | 300 mg/2 ml de seringa pré-cheia com blindagem de agulha | 200 mg/1,14 ml de seringa pré-cheia com blindagem de agulha |
| Pacote de 2 seringas | NDC 0024-5914-01 | NDC 0024-5918-01 |
| Tamanho do pacote | 300 mg/2 ml de caneta pré-cheia | 200 mg/1,14 ml de caneta pré-cheia |
| Pacote de 2 canetas | NDC 0024-5915-02 | NDC 0024-5919-02 |
Armazenamento e manuseio
Dupixent is sterile e preservative-free. Discard any unused portion.
Armazene refrigerado a 2 ° C a 8 ° C (36 ° F a 46 ° F) na caixa original para proteger da luz.
Se necessário, o dupixent pode ser mantido à temperatura ambiente de até 25 ° C (77 ° F) por um máximo de 14 dias. Não armazene acima de 25 ° C (77 ° F). Após a remoção do dupixent da geladeira, deve ser usada dentro de 14 dias ou descartada.
Não exponha o dupixent ao aquecimento ou à luz solar direta.
Não congele. Não agite.
Fabricado por: Regeneron Pharmaceuticals Inc. Tarrytown NY 10591. Comercializado por: Sanofi-Aventis U.S. LLC (Bridgewater NJ 08807) e Regeneron Pharmaceuticals Inc. (Tarrytown NY 10591). Revisado: abril de 2025
Efeitos colaterais para dupixent
As seguintes reações adversas clinicamente significativas são descritas em outras partes da rotulagem:
- Hipersensibilidade [ver Avisos e precauções ]
- Conjuntivite e ceratite [ver Avisos e precauções ]
- Psoríase [veja Avisos e precauções ]
- Artralgia e artrite psoriática [ver Avisos e precauções ]
- Infecções parasitas (helmintos) [ver Avisos e precauções ]
Experiência em ensaios clínicos
Como os ensaios clínicos são conduzidos sob condições amplamente variadas, as taxas de reação adversa observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparados às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Adultos com dermatite atópica
Três ensaios multicêntricos controlados por placebo duplo randomizado (Solo 1 Solo 2 e Chronos) e um estudo de alcance da dose (AD-1021) avaliaram a segurança do dupixent em indivíduos com DA moderada a grave. A população de segurança tinha uma idade média de 38 anos; 41% dos indivíduos eram do sexo feminino 67% eram brancos 24% eram asiáticos e 6% eram negros; Em termos de condições comórbidas, 48% dos indivíduos tinham asma 49% tinham rinite alérgica 37% tinham alergia alimentar e 27% tinham conjuntivite alérgica. Nestes 4 ensaios, 1472 indivíduos foram tratados com injeções subcutâneas de dupixent com ou sem corticosteróides tópicos concomitantes (TCs).
Um total de 739 indivíduos foram tratados com dupixent por pelo menos 1 ano no programa de desenvolvimento para anúncio moderado a grave.
Solo 1 Solo 2 e AD-1021 compararam a segurança da monoterapia com dupixent com o placebo até a semana 16. Os Chronos compararam a segurança dos TCs Dupixent com o placebo TCS até a semana 52.
O AD-1225 é um estudo multicêntrico de extensão de etiqueta aberta (OLE) que avaliou a segurança a longo prazo de doses repetidas de dupixent através de 260 semanas de tratamento em adultos com 3 de 3 anos de retenção de 3 qw 3. MG Q2W em 2677 indivíduos, incluindo 2254 expostos por pelo menos 52 semanas 1224 expostas por pelo menos 100 semanas 561 expostas por pelo menos 148 semanas e 179 expostas por pelo menos 260 semanas.
Semanas 0 a 16 (Solo 1 Solo 2 Chronos e AD-1021)
Nos ensaios de monoterapia com dupixent (Solo 1 Solo 2 e AD-1021) até a semana 16, a proporção de indivíduos que interromperam o tratamento devido a eventos adversos foi de 1,9% nos grupos Dupixent 300 mg Q2W e placebo. A Tabela 7 resume as reações adversas que ocorreram a uma taxa de pelo menos 1% nos grupos de monoterapia Dupixent 300 mg Q2W e no grupo TCS dupixent, tudo a uma taxa mais alta do que em seus respectivos grupos comparadores durante as primeiras 16 semanas de tratamento.
Tabela 7: Reações adversas que ocorrem em ≥1% do grupo de monoterapia dupixent ou no grupo Dupixent TCS nos ensaios de dermatite atópica até a semana 16
| Reação adversa | Dupixent Monotherapya | Dupixent TCSb | ||
| Dupixent 300 mg Q2Wc N = 529 n (%) | Placebo N = 517 n (%) | Dupixent 300 mg Q2Wc TCS N = 110 n (%) | Placebo TCS N = 315 n (%) | |
| Injeção site reaction | 51 (10) | 28 (5) | 11 (10) | 18 (6) |
| Conjuntivited | 51 (10) | 12 (2) | 10 (9) | 15 (5) |
| Blefarite | 2 (<1) | 1 (<1) | 5 (5) | 2 (1) |
| Oual herpes | 20 (4) | 8 (2) | 3 (3) | 5 (2) |
| Ceratitee | 1 (<1) | 0 | 4 (4) | 0 |
| Prurido dos olhos | 3 (1) | 1 (<1) | 2 (2) | 2 (1) |
| Outras infecções por vírus do herpes simplexf | 10 (2) | 6 (1) | 1 (1) | 1 (<1) |
| Olho seco | 1 (<1) | 0 | 2 (2) | 1 (<1) |
| a Análise agrupada de Solo 1 Solo 2 e AD-1021. b Análise de cronos onde os indivíduos estavam na terapia de TCS de fundo. c Dupixent 600 mg at Week 0 followed by 300 mg every 2 weeks. d Conjuntivite cluster includes conjunctivitis allergic conjunctivitis bacterial conjunctivitis viral conjunctivitis giant papillary conjunctivitis eye irritation e eye inflammation. e Ceratite cluster includes keratitis ulcerative keratitis allergic keratitis atopic keratoconjunctivitis e ophthalmic herpes simplex. f Outras infecções por vírus do herpes simplex cluster includes herpes simplex genital herpes herpes simplex otitis externa e herpes virus infection but excludes eczema herpeticum. |
Segurança até a semana 52 (Chronos)
No dupixent com o estudo concomitante do TCS (Chronos) até a semana 52, a proporção de indivíduos que interromperam o tratamento devido a eventos adversos foi de 1,8% no grupo Dupixent 300 mg Q2W TCS e 7,6% no grupo Placebo TCS. Dois indivíduos interromperam o dupixent devido a reações adversas: dermatite atópica (1 sujeito) e dermatite esfoliativa (1 sujeito).
O perfil de segurança do DUPIXENT TCS até a semana 52 era geralmente consistente com o perfil de segurança observado na semana 16.
Segurança até 260 semanas (AD-1225)
O perfil de segurança a longo prazo observado neste estudo por 260 semanas foi geralmente consistente com o perfil de segurança do dupixent observado em estudos controlados.
Indivíduos pediátricos de 12 a 17 anos de idade com dermatite atópica
A segurança do dupixent foi avaliada em um julgamento de 250 indivíduos pediátricos de 12 a 17 anos com AD moderada a grave (AD-1526). O perfil de segurança do dupixent nesses assuntos até a semana 16 foi semelhante ao perfil de segurança observado em adultos com DA.
A segurança a longo prazo do dupixent foi avaliada em um estudo de extensão aberta em indivíduos pediátricos de 12 a 17 anos de idade com AD moderada a grave (AD-1434). O perfil de segurança do dupixent nos indivíduos seguidos até a semana 52 foi semelhante ao perfil de segurança observado na semana 16 no AD-1526. O perfil de segurança a longo prazo do dupixent observado em indivíduos pediátricos de 12 a 17 anos de idade foi consistente com o observado em adultos com DA.
Indivíduos pediátricos 6 a 11 anos de idade com dermatite atópica
A segurança do dupixent com TCs concomitantes foi avaliada em um estudo de 367 indivíduos pediátricos com 6 a 11 anos de idade com DA grave (AD-1652). O perfil de segurança dos TCs Dupixent nesses sujeitos até a semana 16 foi semelhante ao perfil de segurança de ensaios em indivíduos adultos e pediátricos de 12 a 17 anos de idade com DA.
A segurança a longo prazo do dupixent ± TCS foi avaliada em um estudo de extensão de etiqueta aberta de 368 indivíduos pediátricos com 6 a 11 anos de idade com DA (AD-1434). Entre os indivíduos que entraram neste estudo, 110 (30%) tiveram moderado e 72 (20%) apresentaram DA grave no momento da inscrição no AD-1434. O perfil de segurança do dupixent ± TCS nos indivíduos seguidos até a semana 52 foi semelhante ao perfil de segurança observado até a semana 16 no AD-1652. O perfil de segurança a longo prazo de dupixent ± TCS observado em indivíduos pediátricos de 6 a 11 anos de idade foi consistente com o observado em indivíduos adultos e pediátricos de 12 a 17 anos com o AD [ver DA [ver Use em populações específicas ].
Indivíduos pediátricos de 6 meses a 5 anos com dermatite atópica
A segurança do dupixent com TCs concomitantes foi avaliada em um julgamento de 161 indivíduos pediátricos de 6 meses a 5 anos de idade com DA moderada a grave (AD-1539). O perfil de segurança dos TCs Dupixent nesses sujeitos até a semana 16 foi semelhante ao perfil de segurança de ensaios em adultos e indivíduos pediátricos de 6 a 17 anos de idade com a DA.
A segurança a longo prazo do dupixent ± TCS foi avaliada em um estudo de extensão de etiqueta aberta de 180 indivíduos pediátricos de 6 meses a 5 anos de idade com DA (AD-1434). A maioria dos sujeitos foi tratada com dupixent 300 mg a cada 4 semanas. O perfil de segurança do dupixent ± TCS nos indivíduos seguidos até a semana 52 foi semelhante ao perfil de segurança observado até a semana 16 no AD-1539. O perfil de segurança a longo prazo de dupixent ± TCS observado em indivíduos pediátricos de 6 meses a 5 anos de idade foi consistente com o observado em adultos e indivíduos pediátricos de 6 a 17 anos com DA. Além disso, foi relatada uma doença de pés e boca e 9 (5%) indivíduos pediátricos e o papiloma da pele foi relatado em 4 (2%) indivíduos pediátricos tratados com dupixent ± TCs. Esses casos não levaram ao estudo da descontinuação de medicamentos [ver Use em populações específicas ].
Dermatite atópica With He And/Ou Foot Involvement
A segurança do dupixent foi avaliada em um julgamento randomizado de 16 semanas, randomizado duplo-cego, controlado por placebo paralelo (Liberty-Ad) em 133 indivíduos adultos e pediátricos de 12 a 17 anos de idade com dermatite atópica com manual moderada a veveração e/ou envolvimento dos pés [ver consulte [ver consulte o envolvimento [veja vermatite moderada a veveração e/ou pé de pé [veja vermatite moderada a severa e/ou pés [ver consulte a mão e/ou o pé [veja a dermatite moderada a severa e o envolvimento dos pés [ver veja Estudos clínicos ]. In this trial 67 subjects received Dupixent e 66 subjects received placebo. Dupixent-treated subjects received the recommended dosage based on their age e body weight [see Dosagem e administração ]. The safety profile of Dupixent in these subjects through Week 16 was consistent with the safety profile from studies in adult e pediatric subjects 6 months of age e older with moderate-to-severe AD.
Asma
Adultos e indivíduos pediátricos com 12 anos de idade ou mais com asma
Um total de 2888 indivíduos adultos e pediátricos de 12 a 17 anos com asma moderada a grave (AS) foram avaliados em 3 ensaios multicêntricos randomizados controlados por placebo de 24 a 52 semanas de duração (DRI12544 Quest and Venture). Destes, 2678 tinham um histórico de 1 ou mais exacerbações graves no ano anterior à inscrição, apesar do uso regular de corticosteróides inalados médios a altos doses, além de um (s) controlador (s) adicional (s) (DRI12544 e Quest). Um total de 210 indivíduos com asma dependente de corticosteróides orais que recebem corticosteróides inalados por altas doses mais até dois controladores adicionais foram inscritos (empreendimento). A população de segurança (DRI12544 e Quest) tinha 12 a 87 anos de idade, dos quais 63% eram do sexo feminino e 82% eram brancos. Dupixent 200 mg ou 300 mg foi administrado por subcutaneamente Q2W após uma dose inicial de 400 mg ou 600 mg, respectivamente.
No DRI12544 e Quest, a proporção de indivíduos que interromperam o tratamento devido a eventos adversos foi de 4% do grupo placebo 3% do grupo Dupixent 200 mg Q2W e 6% do grupo Dupixent 300 mg Q2W.
A Tabela 8 resume as reações adversas que ocorreram a uma taxa de pelo menos 1% em indivíduos tratados com dupixent e a uma taxa mais alta do que em seus respectivos grupos comparadores no DRI12544 e missão.
Tabela 8: Reações adversas que ocorrem em ≥1% dos indivíduos adultos e pediátricos com 12 anos de idade ou mais com asma nos grupos dupixents no DRI12544 e MESS e Maior que o placebo (pool de segurança de 6 meses)
| Reação adversa | Dri12544 e Quest | ||
| Dupixent200 mg Q2W N = 779 n (%) | Dupixent300 mg Q2W N = 788 n (%) | Placebo N = 792 n (%) | |
| Injeção site reactionsa | 111 (14%) | 144 (18%) | 50 (6%) |
| Ouopharyngeal pain | 13 (2%) | 19 (2%) | 7 (1%) |
| Eosinofiliab | 17 (2%) | 16 (2%) | 2 (<1%) |
| a Injeção site reactions cluster includes erythema edema pruritus pain e inflammation. b Eosinofilia = blood eosinophils ≥3000 cells/mcL or deemed by the investigator to be an adverse event. None met the criteria for serious eosinophilic conditions [see Avisos e precauções ]. |
Injeção site reactions were most common with the loading (initial) dose.
O perfil de segurança do dupixent até a semana 52 era geralmente consistente com o perfil de segurança observado na semana 24.
Indivíduos pediátricos de 6 a 11 anos de idade com asma
A segurança do dupixent foi avaliada em 405 indivíduos pediátricos com 6 a 11 anos de idade com asma moderada a grave (viagem). O perfil de segurança do dupixent nesses sujeitos até a semana 52 foi semelhante ao perfil de segurança de estudos em indivíduos adultos e pediátricos com 12 anos de idade e mais com asma moderada a grave com a adição de infecções por helmintos. Infecções helmintas foram relatadas em 2,2% (6 indivíduos) no grupo dupixent e 0,7% (1 sujeito) no grupo placebo. A maioria dos casos foi a enterobíase relatada em 1,8% (5 indivíduos) no grupo dupixent e nenhum no grupo placebo. Houve um caso de ascariase no grupo dupixent. Todos os casos de infecção por helmintos foram leves a moderados e indivíduos recuperados com tratamento anti-helmintura sem descontinuação do tratamento com dupixent.
Rinossinusite crônica com pólipos nasais
Um total de 722 indivíduos adultos com rinossinusite crônica com pólipos nasais (CRSWNP) foram avaliados em 2 ensaios multicêntricos randomizados controlados por placebo de 24 a 52 semanas de duração (seio -24 e seio-52). O pool de segurança consistiu em dados das primeiras 24 semanas de tratamento de ambos os estudos.
No pool de segurança, a proporção de indivíduos adultos que interromperam o tratamento devido a eventos adversos foi de 5% do grupo placebo e 2% do grupo dupixent 300 mg Q2W.
A Tabela 9 resume as reações adversas que ocorreram a uma taxa de pelo menos 1% em indivíduos adultos tratados com dupixent e a uma taxa mais alta do que em seu respectivo grupo comparador no seio-24 e no seio-52.
Tabela 9: Reações adversas que ocorrem em ≥1% dos indivíduos adultos com CRSWNP no grupo dupixent no seio-24 e no seio-52 e maior que o placebo (pool de segurança de 24 semanas)
| Reação adversa | Sinus-24 e Sinus-52 | |
| Dupixent 300 mg Q2W N = 440 n (%) | Placebo N = 282 n (%) | |
| Injeção site reactionsa | 28 (6%) | 12 (4%) |
| Conjuntiviteb | 7 (2%) | 2 (1%) |
| Arthralgia | 14 (3%) | 5 (2%) |
| Gastrite | 7 (2%) | 2 (1%) |
| Insônia | 6 (1%) | 0 (<1%) |
| Eosinofilia | 5 (1%) | 1 (<1%) |
| Dor de dente | 5 (1%) | 1 (<1%) |
| a Injeção site reactions cluster includes injection site reaction pain bruising e swelling. b Conjuntivite cluster includes conjunctivitis allergic conjunctivitis bacterial conjunctivitis viral conjunctivitis giant papillary conjunctivitis eye irritation e eye inflammation. |
O perfil de segurança do dupixent até a semana 52 era geralmente consistente com o perfil de segurança observado na semana 24.
Esofagite eosinofílica
Adultos e indivíduos pediátricos com 12 anos de idade ou mais com EOE
Um total de 239 indivíduos adultos e pediátricos com 12 anos de idade e idosos pesando pelo menos 40 kg com EOE foram avaliados em um estudo controlado por placebo multicêntrico de grupo paralelo duplo randomizado, incluindo dois períodos de tratamento de 24 semanas (estudo EOE-1 Partes A e B) e recebeu Dupixent 300 Mg QW ou Placebo [Veja Estudos clínicos ].
A proporção de indivíduos que interromperam o tratamento devido a eventos adversos foi de 2% do grupo placebo e 2% do grupo Dupixent 300 mg QW.
A Tabela 10 resume as reações adversas que ocorreram a uma taxa de pelo menos 2% em indivíduos tratados com dupixent e a uma taxa mais alta do que em seu respectivo grupo comparador nas partes A e B.
Tabela 10: Reações adversas que ocorrem em ≥2% dos indivíduos adultos e pediátricos de 12 anos ou mais com EOE tratados com dupixent em um estudo controlado por placebo (estudo EOE-1 Partes A e B; Pool de Segurança de 24 semanas)
| Reação adversa | Estude as partes EoE-1 A e B | |
| Dupixent 300 mg QW N = 122 n (%) | Placebo N = 117 n (%) | |
| Injeção site reactionsa | 46 (38%) | 39 (33%) |
| Infecções do trato respiratório superiorb | 22 (18%) | 12 (10%) |
| Arthralgia | 3 (2%) | 1 (1%) |
| Herpes infecções viraisc | 3 (2%) | 1 (1%) |
| a Injeção site reactions are composed of several terms including but not limited to injection site swelling pain e bruising. b Infecções do trato respiratório superior are composed of several terms including but not limited to COVID-19 sinusitis e upper respiratory tract infection. c Herpes infecções virais are composed of oral herpes e herpes simplex. |
O perfil de segurança do dupixent em 72 indivíduos pediátricos de 12 a 17 anos de idade pesando pelo menos 40 kg e os adultos nas partes A e B foi semelhante.
Indivíduos pediátricos 1 a 11 anos de idade pesando pelo menos 15 kg com EoE
Um total de 61 indivíduos pediátricos 1 a 11 anos de idade, com peso de pelo menos 15 kg com EOE, foram avaliados em um estudo multicêntrico de grupo paralelo randomizado, incluindo um período inicial de tratamento controlado por placebo de 16 semanas (Estudo EOE-2 Parte A) e um período de tratamento ativo de 36 semanas (estudo EOE-2 Parte B). Os sujeitos da Parte A receberam um regime de dosagem baseado em peso de dupixent ou placebo [ver Estudos clínicos ]. All subjects in Part B completed Part A e received active treatment with weight-based dosing regimens of Dupixent in Part B (N=47).
O perfil de segurança do dupixent até a semana 16 do estudo EOE-2 Parte A geralmente era semelhante ao perfil de segurança em indivíduos adultos e pediátricos com 12 anos de idade ou mais com o EOE. Na Parte B, uma infecção por helminto foi relatada em um sujeito tratado com dupixent.
Prurigo nodularis
Um total de 309 indivíduos adultos com prurigo nodularis (PN) foram avaliados em dois ensaios multicêntricos randomizados de 24 semanas, com controlamento de placebo duplo (Prime e Prime2). O pool de segurança incluiu dados do tratamento de 24 semanas e períodos de acompanhamento de 12 semanas de ambos os ensaios.
A proporção de indivíduos que interromperam o tratamento devido a eventos adversos foi de 3% do grupo placebo e 0% do grupo dupixent 300 mg Q2W.
A população de segurança tinha uma idade média de 49 anos; 65% dos indivíduos eram do sexo feminino 56% eram brancos 34% eram asiáticos e 6% eram negros ou afro -americanos. Indivíduos com condições crobides incluíram 43% dos indivíduos com histórico de atropia (definido como tendo um histórico médico de rinite alérgica de anúncio/conjuntivite da conjuntivite ou alergia alimentar) 8% dos indivíduos com histórico de hipotireoidismo e 9% dos sujeitos com histórico de histórico de Diabetes mellitus Tipo 2.
A Tabela 11 resume as reações adversas que ocorreram a uma taxa de pelo menos 2% em indivíduos tratados com dupixent e a uma taxa mais alta do que em seu respectivo grupo comparador no Prime e Prime2.
Tabela 11: reações adversas que ocorrem em ≥2% dos indivíduos adultos com PN no grupo dupixent no Prime e Prime2 e maior que o placebo
| Reação adversa | Prime e Prime2 | |
| Dupixent 300 mg Q2W N = 152 n (%) | Placebo N = 157 n (%) | |
| Nasofaringitea | 8 (5%) | 3 (2%) |
| Conjuntiviteb | 6 (4%) | 2 (1%) |
| Infecção por herpesc | 5 (3%) | 0% |
| Tonturad | 5 (3%) | 2 (1%) |
| Mialgiae | 5 (3%) | 2 (1%) |
| Diarréia | 4 (3%) | 1 (1%) |
| a Nasofaringite includes pharyngitis b Conjuntivite includes conjunctivitis e allergic conjunctivitis. c A infecção pelo herpes inclui herpes orais herpes herpes simplex herpes zoster e herpes oftálmico zoster d Tontura includes tontura postural vertigo e vertigo positional e Mialgia includes musculoskeletal pain e musculoskeletal dor no peito |
Doença pulmonar obstrutiva crônica
Um total de 1874 indivíduos adultos com doença pulmonar obstrutiva crônica controlada inadequadamente controlada (DPOC) e um fenótipo eosinofílico foram avaliados em dois ensaios paralelos multicêntricos e duplos randomizados com um período de tratamento com um grupo paralelo com 52 semanas (Boreas e Notus) [veja) [veja o Boreas e o notarus) [veja verbus Estudos clínicos ]. Of those reomized 1872 subjects received at least one dose of Dupixent 300 mg or placebo subcutaneously every 2 weeks (Q2W). The safety of Dupixent was assessed in the pooled safety population from Boreas e conhecidos which consisted of 938 adult subjects treated with Dupixent. Of the subjects treated with Dupixent 98% utilized inhaled triple therapy at baseline (comprising of an inhaled corticosteroid long-acting beta-agonista e antagonista muscarínico de ação prolongada) e 97% tiveram bronquite crônica.
A Tabela 12 resume as reações adversas que ocorreram em pelo menos 2% dos indivíduos tratados com dupixent e a uma taxa mais alta que o placebo em ensaios de Boreas e Notus.
Tabela 12: Reações adversas que ocorreram em ≥2% dos indivíduos adultos com DPOC tratada com dupixent em ensaios de Boreas e Notus (população de segurança combinada) e maior que o placebo
| Reação adversa | Boreas e conhecidos | |
| Dupixent 300 mg Q2W N = 938 n (%) | Placebo N = 934 n (%) | |
| Infecção virala | 133 (14.2) | 115 (12.3) |
| Dor de cabeça | 73 (7,8) | 62 (6.6) |
| Nasofaringite | 73 (7,8) | 69 (7,4) |
| Dor nas costas | 42 (4,5) | 29 (3.1) |
| Diarréiaa | 35 (3,7) | 30 (3.2) |
| Arthralgia | 29 (3.1) | 25 (2.7) |
| Infecção do trato urinário | 28 (3.0) | 18 (1.9) |
| Reação da administração locala | 26 (2.8) | 6 (0,6) |
| Injeção Site Reaction | 11 (1.2) | 2 (0.2) |
| Rinite | 24 (2.6) | 17 (1.8) |
| Eosinofiliab | 22 (2.3) | 7 (0,7) |
| Dor de dente | 20 (2.1) | 11 (1.2) |
| Gastrite | 19 (2) | 7 (0,7) |
| a Consiste em vários termos semelhantes. b Eosinofilia was defined as blood eosinophils ≥3000 cells/mcL or deemed by the investigator to be an adverse event. None met the criteria for serious eosinophilic conditions. |
Reação adversa menos comum em indivíduos com DPOC: colecistite
Em indivíduos adultos com colecistite da DPOC, foi relatada em 6 indivíduos (0,6%) no grupo dupixent em comparação com 1 sujeito (0,1%) no grupo placebo. Entre esses indivíduos, a colecistite grave foi relatada em 4 (0,4%) do grupo dupixent em comparação com 0% do grupo placebo.
Urticária espontânea crônica
Os dados de segurança combinados abaixo refletem a segurança do dupixent em indivíduos adultos e pediátricos com 12 anos de idade ou mais com urticária espontânea crônica (CSU) que permanecem sintomáticas apesar do tratamento anti -histamínico de H1. Um total de 392 indivíduos adultos e pediátricos com 12 anos de idade ou mais com a CSU foram avaliados quanto à segurança em três estudos randomizados de estudos controlados por placebo de grupo paralelo duplo duplo-cego, realizado sob um protocolo mestre (cupido) por 36 semanas [consulte Estudos clínicos ]. The pooled safety population received an initial dose of Dupixent 600 mg or 400 mg followed by Dupixent 300 mg or 200 mg respectively or matching placebo administered subcutaneously every 2 weeks (Q2W) [see Dosagem e administração ].
A Tabela 13 resume as reações adversas que ocorreram em pelo menos 2% em indivíduos tratados com dupixent e a uma taxa mais alta que o placebo no estudo do Cupido A B e C (população de segurança combinada).
Tabela 13: Reações adversas que ocorreram em ≥2% dos indivíduos adultos e pediátricos com 12 anos de idade ou mais com a CSU tratada com dupixent no estudo do Cupido A B e C (população de segurança combinada) e maior que o placebo
| Reação adversa | Cupido estuda A B e C | |
| Dupixent200 mg Q2W or 300 mg Q2W N = 195 n (%) | Placebo N = 197 n (%) | |
| Injeção site reactionsa | 20 (10.3) | 16 (8.1) |
| a Injeção site reactions cluster includes injection site dermatitis injection site erythema injection site hematoma injection site induration injection site pain injection site pruritus injection site reaction injection site swelling |
Reações adversas específicas para ad asma CRSWNP EOE PN COPD e CSU
Conjuntivite And Ceratite
Em indivíduos adultos com conjuntivite de DA, foi relatada em 10% (34 por 100 anos-ano) no grupo de 300 mg de Q2W e em 2% do grupo placebo (8 por 100 anos-ano) durante o período de tratamento de 16 semanas dos ensaios de monoterapia (Solo 1 Solo 2 e AD-1021). Durante o período de tratamento de 52 semanas da conjuntivite concomitante de terapia AD (Chronos), foi relatada em 16% do grupo Dupixent 300 mg Q2W TCS (20 por 100 anos) e em 9% do grupo Placebo TCS (10 por 100 anos). Durante o estudo OLE de longo prazo, com dados por 260 semanas (AD-1225), foi relatada a conjuntivite em 21% do grupo dupixent (12 por 100 anos-ano).
pílula do mal
Nos ensaios de monoterapia com Dupixent Ad (Solo 1 Solo 2 e AD-1021) até a semana 16, a ceratite foi relatada em <1% of the Dupixent group (1 per 100 subject-years) e in 0% of the placebo group (0 per 100 subject-years). In the 52-week Dupixent + topical corticosteroids (TCS) AD trial (Chronos) keratitis was reported in 4% of the Dupixent TCS group (4 per 100 subject-years) e in 2% of the placebo TCS group (2 per 100 subjectyears). Conjuntivite e keratitis occurred more frequently in AD subjects who received Dupixent. Conjuntivite was the most frequently reported eye disorder. During the long-term OLE trial with data through 260 weeks (AD-1225) keratitis was reported in 3% of the Dupixent group (1 per 100 subject-years). Most subjects with conjunctivitis or keratitis recovered or were recovering during the treatment period.
Entre os indivíduos com asma, a frequência de conjuntivite e ceratite foi semelhante entre dupixent e placebo.
Em indivíduos adultos com CRSWNP, a frequência da conjuntivite foi de 2% no grupo dupixent em comparação com 1% no grupo placebo no pool de segurança de 24 semanas; esses sujeitos recuperaram.
No estudo CRSWNP de 52 semanas (seio 52), a frequência da conjuntivite foi de 3% nos indivíduos adultos dupixent e 1% nos indivíduos com placebo; Todos esses assuntos recuperaram. Não houve casos de ceratite relatados no Programa de Desenvolvimento do CRSWNP [ver Avisos e precauções ].
Entre os indivíduos com EoE, não houve relatos de conjuntivite e ceratite no grupo dupixent em ensaios controlados por placebo [ver Avisos e precauções ]. In the 36- week active treatment extension period of Study Eoe-2 Part B conjunctivitis was reported in 4% of Dupixent-treated pediatric subjects with Eoe.
Entre os indivíduos com PN, a frequência da conjuntivite foi de 4% no grupo dupixent em comparação com 1% no grupo placebo; Todos esses sujeitos se recuperaram ou estavam se recuperando durante o período de tratamento. Não houve casos de ceratite relatados no Programa de Desenvolvimento da PN [ver Avisos e precauções ].
Entre os indivíduos com DPOC, a frequência de conjuntivite e ceratite foi de 1,4% e 0,1% no grupo dupixent e 1% e 0% no grupo placebo, respectivamente, [ver Avisos e precauções ].
Entre os indivíduos com CSU na população de segurança combinada, a frequência da conjuntivite foi semelhante entre dupixent e placebo. Não houve casos de ceratite relatados no Programa de Desenvolvimento da CSU [ver Avisos e precauções ].
Eczema herpeticum e herpes zoster
A taxa de eczema herpeticum foi semelhante nos grupos placebo e dupixent nos ensaios de DA. As taxas permaneceram estáveis através de 260 semanas no estudo OLE de longo prazo (AD-1225).
Herpes Zoster foi relatado em <1% of the Dupixent groups (1 per 100 subject-years) e in <1% of the placebo group (1 per 100 subject-years) in the 16-week AD monotherapy trials. In the 52-week Dupixent TCS AD trial herpes zoster was reported in 1% of the Dupixent TCS group (1 per 100 subject-years) e 2% of the placebo TCS group (2 per 100 subjectyears). During the long-term OLE trial with data through 260 weeks (AD-1225) 2.0% of Dupixent-treated subjects reported herpes zoster (0.94 per 100 subject-years of follow up). Among asthma subjects the frequency of herpes zoster was similar between Dupixent e placebo. Among subjects with CRSWNP or Eoe there were no reported cases of herpes zoster or eczema herpeticum.
Entre os sujeitos com Herpes Zoster e Herpes Zoster oftálmicos foram relatados em <1% of the Dupixent group (1 per 100 subject-years) e 0% of the placebo group.
Entre os indivíduos com Herpes Zoster, foi relatado em 0,9% do grupo dupixent e 0,2% do grupo placebo. O herpes oftálmico Zoster foi relatado em 0,1% do grupo dupixent e 0,2% do grupo placebo.
Entre os sujeitos com CSU na população de segurança agrupada, o herpes zoster foi relatado em <1% of the Dupixent e placebo groups (1 per 100 subject-years). There were no cases of eczema herpeticum reported in the CSU development program.
Reações de hipersensibilidade
Reações de hipersensibilidade foram relatadas em <1% of Dupixent-treated subjects. These included anaphylaxis serum sickness or serum sickness-like reactions generalized urticaria irritação na pele erythema nodosum e erythema multiforme [see Contra -indicações Avisos e precauções e Farmacologia Clínica ].
Eosinófilos
Dupixent-treated subjects with AD asthma CRSWNP e COPD had a greater initial increase from baseline in blood eosinophil count compared to subjects treated with placebo. In adult subjects with AD (Apenas 1 Apenas 2 e AD-1021) the mean e median increases in blood eosinophils from baseline to Week 4 were 100 e 0 cells/mcL respectively. In pediatric subjects <6 years old with AD the mean e median increases from baseline to week 4 were 478 e 90 cells/mcL respectively.
Nos indivíduos adultos e pediátricos de 12 anos ou mais com asma (DRI12544 e Quest), os aumentos médios e medianos nos eosinófilos sanguíneos da linha de base para a semana 4 foram de 130 e 10 células/MCL, respectivamente. Nos indivíduos de 6 a 11 anos de idade com asma (viagem), os aumentos médios e medianos nos eosinófilos sanguíneos da linha de base para a semana 12 foram de 124 e 0 células/MCL, respectivamente.
Em indivíduos adultos com CRSWNP (sinus-24 e sinus-52), os aumentos médios e medianos nos eosinófilos sanguíneos da linha de base para a semana 16 foram de 150 e 50 células/MCL, respectivamente. Em indivíduos com DPOC (Boreas e Notus), os aumentos médios e medianos nos eosinófilos sanguíneos da linha de base para a semana 8 foram de 60 e 0 células/MCL, respectivamente.
Um aumento da linha de base na contagem de eosinófilos sanguíneos não foi observado em indivíduos adultos e pediátricos com 12 anos de idade ou mais com EOE tratado com dupixent em comparação com o placebo (estudo EOE-1). Em indivíduos pediátricos 1 a 11 anos de idade com EOE (estudo EOE-2 Parte A), a contagem de eosinófilos do sangue era geralmente consistente com os observados no estudo EOE-1.
Em indivíduos adultos e pediátricos com CSU (estudo de cupido, um estudo b e estudo c) tratado com dupixent Um aumento da linha de base na contagem de eosinófilos no sangue não foi observado em comparação com o placebo na semana 12.
Em indivíduos com PN (Prime e Prime2), a diminuição média e mediana dos eosinófilos sanguíneos da linha de base para a semana 4 foram 9 e 10 células/MCL, respectivamente.
Nos ensaios para a eosinofilia emergente de tratamento com indicação de DPOC (células ≥500/MCL) foi maior em dupixent (41,7%) do que no grupo placebo (39,4%); Nenhum dos casos foi associado a sintomas clínicos e eosinofilia emergente do tratamento (≥1000 células/MCL) foi maior em dupixent (13,6%) do que no grupo placebo (8,1%).
Nos ensaios para as indicações de CRSWNP e CSU de asma, a incidência de eosinofilia de tratamento de tratamento (≥500 células/MCL) foi semelhante nos grupos dupixent e placebo.
Nos ensaios para a indicação de PN, a incidência de eosinofilia emergente de tratamento (≥500 células/MCL) foi menor em dupixent do que no grupo placebo.
Eosinofilia emergente de tratamento (≥5000 células/MCL) foi observada em <3% of Dupixenttreated subjects e <0.5% in placebo-treated subjects (Apenas 1 Apenas 2 e AD-1021; DRI12544 BUSCA e VIAGEM; Sinus-24 e Sinus-52; Prime e Prime2; Boreas e conhecidos; Cupido estuda A B e C). Blood eosinophil counts declined to near baseline or remained below baseline levels (Prime e Prime2; Boreas e conhecidos) during study treatment. In study AD-1539 treatment-emergent eosinofilia (≥5000 cells/mcL) was reported in 8% of Dupixent-treated subjects e 0% in placebo-treated subjects [see Avisos e precauções ].
Eventos tromboembólicos cardiovasculares
No estudo controlado por placebo de 1 ano, em indivíduos adultos e pediátricos, com 12 anos de idade e mais com os eventos tromboembólicos cardiovasculares da asma (Quest) (mortes cardiovasculares não fatais de infarctions miocárdicas e strokes não-fatais 4 (0,2%) do Dupixent 200 MG Q2W GROUP 4 (0,3%) do grupo placebo.
No estudo controlado por placebo de 1 ano, em indivíduos com eventos tromboembólicos cardiovasculares da DA (Chronos) (mortes cardiovasculares infarctores miocárdicos não fatais e traços não fatais) foram relatados em 1 mg (0,9%) do Dupixent 300 Mg Q2W Grupo 0 (0,0%) O grupo Placebo TCS.
No estudo controlado por placebo de 24 semanas, em indivíduos adultos com eventos tromboembólicos cardiovasculares CRSWNP (sinusse-24) (mortes cardiovasculares não fatais infarções miocárdicas e traços não fatais) foram relatados em 1 (0,7%) do grupo dupixent e 0 (0,0%) do grupo.
No estudo controlado por placebo de 1 ano em indivíduos adultos com CRSWNP (seio 52), não houve casos de eventos tromboembólicos cardiovasculares (mortes cardiovasculares não fatais infarções miocárdicas e traços não fatais) relatados em qualquer braço de tratamento.
No estudo controlado por placebo de 24 semanas em indivíduos com EOE (Estudo EOE-1 Partes A e B), não houve casos de eventos tromboembólicos cardiovasculares (mortes cardiovasculares não fatais do miocárdio e traços não fatais) relatados em qualquer braço de tratamento.
No estudo controlado por placebo de 24 semanas em indivíduos com CSU (estudo do cupido A B e C), não houve casos de eventos tromboembólicos cardiovasculares (mortes cardiovasculares não fatais do miocárdio e traços não fatais) relatados em qualquer braço de tratamento.
Experiência de pós -mercado
As seguintes reações adversas foram identificadas durante o uso pós-aprovação do dupixent. Como essas reações são relatadas voluntariamente de uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal à exposição a medicamentos.
- Distúrbios do sistema imunológico: Angioedema
- Distúrbios do sistema musculoesquelético: Artrite psoriática
- Distúrbios da pele e do tecido subcutâneo: Reações faciais da pele, incluindo edema de escala de eritema, edema Papules prurido queima e dor; vasculite da psoríase de início recente
Interações medicamentosas para dupixent
Nenhuma informação fornecida
Avisos para dupixent
Incluído como parte do PRECAUÇÕES seção.
Precauções para dupixent
Hipersensibilidade
Hipersensibilidade reactions including anaphylaxis serum sickness or serum sickness-like reactions Angioedema generalized urticaria irritação na pele erythema nodosum e erythema multiforme have been reported. If a clinically significant hypersensitivity reaction occurs institute appropriate therapy e discontinue Dupixent [see Reações adversas e Farmacologia Clínica ].
Conjuntivite And Ceratite
Conjuntivite e keratitis adverse reactions have been reported in clinical trials.
Conjuntivite e keratitis occurred more frequently in AD subjects who received Dupixent compared to those who received placebo. Conjuntivite was the most frequently reported eye disorder. Most subjects with conjunctivitis or keratitis recovered or were recovering during the treatment period [see Reações adversas ].
Entre os indivíduos com asma, as frequências de conjuntivite e ceratite foram semelhantes entre dupixent e placebo [ver Reações adversas ].
Em indivíduos adultos com CRSWNP, a frequência da conjuntivite foi de 2% no grupo dupixent em comparação com 1% no grupo placebo no pool de segurança de 24 semanas; esses sujeitos recuperaram. There were no cases of keratitis reported in the CRSWNP development program [see Reações adversas ].
Entre os indivíduos com EoE, não houve relatos de conjuntivite e ceratite no grupo dupixent em ensaios controlados por placebo [ver Reações adversas ].
Em indivíduos com PN, a frequência da conjuntivite foi de 4% no grupo dupixent em comparação com 1% no grupo placebo; Esses indivíduos se recuperaram ou estavam se recuperando durante o período de tratamento. Não houve casos de ceratite relatados no Programa de Desenvolvimento da PN [ver Reações adversas ].
Entre os indivíduos com DPOC, a frequência de conjuntivite e ceratite foi de 1,4% e 0,1% no grupo dupixent e 1% e 0% no grupo placebo, respectivamente, [ver Reações adversas ].
Em indivíduos com CSU, a frequência da conjuntivite foi semelhante entre dupixent e placebo. Não houve casos de ceratite relatados no Programa de Desenvolvimento da CSU [ver Reações adversas ].
Conjuntivite e keratitis adverse events have also been reported with Dupixent in postmarketing settings predominantly in AD patients. Some patients reported visual disturbances (e.g. blurred vision) associated with conjunctivitis or keratitis.
Aconselhe os pacientes ou seus cuidadores a relatar novos sintomas oculares de início ou piorar o seu provedor de saúde. Considere o exame oftalmológico para pacientes que desenvolvem conjuntivite que não resolve seguindo o tratamento padrão ou sinais e sintomas sugestivos de ceratite conforme apropriado [ver Reações adversas ].
Condições eosinofílicas
Os pacientes que estão sendo tratados para asma podem apresentar características clínicas de pneumonia eosinofílica ou granulomatose eosinofílica com polangiite (EGPA). Esses eventos podem estar associados à redução da terapia com corticosteróides orais. Os prestadores de serviços de saúde devem estar alertas sobre a erupção cutânea vasculítica que piora os sintomas pulmonares complicações cardíacas lesões renais e/ou neuropatia que se apresentam em seus pacientes com eosinofilia. Casos de pneumonia eosinofílica foram relatados em adultos que participaram do programa de desenvolvimento da asma. Casos de EGPA foram relatados com dupixent em adultos que participaram do Programa de Desenvolvimento de Astma, bem como em adultos com asma comodinha no Programa de Desenvolvimento do CRSWNP. Aconselhe os pacientes a relatar sinais de pneumonia eosinofílica e EGPA ao seu médico. Considere reter dupixent se houver suspeita de pneumonia eosinofílica ou EGPA.
Sintomas agudos de asma ou doença pulmonar obstrutiva crônica ou doença de deterioração aguda
Dupixent should not be used to treat acute symptoms or acute exacerbations of asthma or COPD. Não use dupixent to treat acute bronchospasm or status asthmaticus. Patients should seek medical advice if their asthma or COPD remains uncontrolled or worsens after initiation of treatment with Dupixent.
Risco associado à redução abrupta da dose de corticosteróide
Não interrompa os corticosteróides tópicos ou inalados sistêmicos abruptamente após o início da terapia com dupixent. Reduções na dose de corticosteróide, se apropriado, devem ser graduais e executadas sob a supervisão direta de um profissional de saúde. A redução na dose de corticosteróide pode estar associada a sintomas de abstinência sistêmica e/ou condições de desmascarar previamente suprimidas pela terapia sistêmica de corticosteróides.
Pacientes com asma-mórbida
Aconselhe os pacientes com asma co-mórbida a não ajustar ou interromper seus tratamentos de asma sem consulta com seus médicos.
Psoríase
Casos de psoríase de início recente foram relatados com o uso de dupixent para o tratamento da dermatite atópica e asma, inclusive em pacientes sem histórico familiar de psoríase. Nos relatórios de pós -mercado, o início da psoríase variou de semanas a meses após a primeira dose de dupixent e resultou em resolução parcial ou completa da psoríase com a descontinuação do dupilumab com ou sem uso de tratamento suplementar para psoríase (tópico ou sistêmico). Aqueles que continuaram no dupilumab receberam tratamento suplementar para psoríase para melhorar os sintomas associados. Aconselhe os pacientes a relatar sintomas de psoríase de início recente ao seu médico. Se os sintomas persistirem ou piorar, considere a avaliação dermatológica e/ou a descontinuação do dupixent.
Arthralgia And Psoriatic Arthritis
Arthralgia has been reported with the use of Dupixent with some patients reporting gait disturbances or decreased mobility associated with joint symptoms; some cases resulted in hospitalization [see Reações adversas ]. In postmarketing reports onset of arthralgia was variable ranging from days to months after the first dose of Dupixent.
Casos de artrite psoriática de início recente que requerem tratamento sistêmico foram relatados com o uso de dupixent.
Alguns pacientes '
Aconselhe os pacientes a relatar novos sintomas conjuntos de início ou pior ao seu médico. Se os sintomas persistirem ou piorarem, considere avaliação reumatológica e/ou descontinuação do dupixent.
Infecções parasitas (helmintos)
Pacientes com infecções conhecidos de helminto foram excluídos da participação em estudos clínicos. Não se sabe se o dupixent influenciará a resposta imune contra infecções por helmintos.
Trate os pacientes com infecções por helmintos pré-existentes antes de iniciar a terapia com dupixent. Se os pacientes forem infectados durante o tratamento com dupixent e não responderem ao tratamento anti -helminto, interrompe o tratamento com dupixent até que a infecção resolva. As reações adversas de infecções por helmintos (5 casos de enterobíase e 1 caso de asparíase) foram relatadas em indivíduos pediátricos de 6 a 11 anos que participaram do Programa de Desenvolvimento de Asthma Pediátrica [ver ver Reações adversas ].
Vacinas
Considere concluir todas as vacinas apropriadas para a idade, conforme recomendado pelas diretrizes atuais de imunização antes de iniciar o tratamento com dupixent. Evite o uso de vacinas vivas durante o tratamento com dupixent. Não se sabe se a administração de vacinas vivas durante o tratamento com dupixent afetará a segurança ou a eficácia dessas vacinas. Dados limitados estão disponíveis sobre a co-administração de dupixent com vacinas não-vivas [ver Farmacologia Clínica ].
Informações de aconselhamento para pacientes
Aconselhe o paciente a ler a rotulagem de pacientes aprovados pela FDA ( Informação do paciente e instruções para uso ).
Registro de gravidez
Há um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a dupixent durante a gravidez. Incentive a participação e aconselhar os pacientes sobre como eles podem se inscrever no registro [ver Use em populações específicas ].
Instruções de administração
Forneça treinamento adequado aos pacientes e/ou cuidadores sobre a técnica de injeção subcutânea adequada, incluindo técnica asséptica e a preparação e administração de dupixent antes do uso. Aconselhe os pacientes a seguir as recomendações de descarte da SHOTS [ver Dosagem e administração e Instruções para uso ].
Hipersensibilidade
Aconselhe os pacientes a interromper o dupixent e procurar atendimento médico imediato se sofrerem algum sintoma de reações sistêmicas de hipersensibilidade [ver Avisos e precauções ].
Conjuntivite And Ceratite
Aconselhe os pacientes a consultar seu médico se o novo início ou pior dos sintomas oculares se desenvolverem [ver Avisos e precauções ].
Condições eosinofílicas
Aconselhe os pacientes a notificar seu médico se apresentarem características clínicas de pneumonia eosinofílica ou granulomatose eosinofílica com polangiite [ver [ver Avisos e precauções ].
Não para sintomas agudos de asma ou doença pulmonar obstrutiva crônica ou doença de deterioração aguda
Informe os pacientes que o dupixent não trata sintomas agudos ou exacerbações agudas da asma ou DPOC. Informe os pacientes para procurar aconselhamento médico se sua asma ou DPOC permanecer descontrolada ou piorar após o início do tratamento com dupixent [ver Avisos e precauções ].
Redução na dose de corticosteróide
Informe os pacientes para não interromper os corticosteróides sistêmicos ou inalados, exceto sob a supervisão direta de um profissional de saúde. Informe os pacientes que a redução na dose de corticosteróide pode estar associada a sintomas de abstinência sistêmica e/ou condições de desmascarar previamente suprimidas pela terapia sistêmica de corticosteróides [ver Avisos e precauções ].
Pacientes com asma-mórbida
Aconselhe os pacientes com asma co-mórbida a não ajustar ou interromper o tratamento da asma sem conversar com seus profissionais de saúde [ver Avisos e precauções ].
Psoríase
Aconselhe os pacientes que os casos de psoríase de início recente foram relatados com o uso de dupixent. Aconselhe os pacientes a relatar sintomas de psoríase de início recente ao seu provedor de saúde [ver Avisos e precauções ].
Arthralgia And Psoriatic Arthritis
Aconselhe os pacientes que casos de artrite psoriática de início recente foram relatados com o uso de dupixent. Aconselhar os pacientes a relatar novos sintomas conjuntos de início ou pior ao seu provedor de saúde [ver Avisos e precauções ].
Infecções parasitas (helmintos)
Aconselhe os pacientes a notificar seu médico se apresentarem características clínicas consistentes com a infecção helmíntica [ver Avisos e precauções ].
Vacinas
Aconselhe os pacientes que a vacinação com vacinas vidas não é recomendada imediatamente antes e enquanto eles estão recebendo dupixent. Instrua os pacientes a informar seu médico que estão tomando dupixent antes de uma potencial vacinação [ver Avisos e precauções ].
Toxicologia não clínica
Carcinogênese mutagênese comprometimento da fertilidade
Estudos em animais não foram conduzidos para avaliar o potencial carcinogênico ou mutagênico do dupilumab.
Não foram observados efeitos nos parâmetros de fertilidade, como os órgãos reprodutivos, o comprimento menstrual do ciclo ou a análise de espermatozóides em camundongos sexualmente maduros que foram subcutâneos administraram um anticorpo homólogo contra a IL-4Rα em doses de até 200 mg/kg/semana.
Use em populações específicas
Gravidez
Gravidez Exposure Registry
Há um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a dupixent durante a gravidez.
Os profissionais de saúde e os pacientes podem ligar para 1-877-311-8972 ou acessar https://mothertobaby.org/ongoing-study/dupixent/ para se inscrever ou obter informações sobre o registro.
Resumo do risco
Os dados disponíveis de relatos de casos e séries de casos com uso de dupixent em mulheres grávidas não identificaram um risco associado a medicamentos de defeitos congênitos graves ou resultados adversos maternos ou fetais. Sabe -se que os anticorpos IgG humanos atravessam a barreira placentária; Portanto, o dupixent pode ser transmitido da mãe para o feto em desenvolvimento. Existem efeitos adversos nos resultados maternos e fetais associados à asma na gravidez (ver Considerações clínicas ). In an enhanced pre- e post-natal developmental study no adverse developmental effects were observed in offspring born to pregnant monkeys after subcutaneous administration of a homologous antibody against interleukin-4-receptor alpha (IL-4Rα) during organogenesis through parturition at doses up to 10-times the maximum recommended human dose (MRHD) (see Dados ).
O risco de fundo de principais defeitos congênitos e aborto para as populações indicadas são desconhecidas. Todas as gestações têm um risco de perda de defeitos congênitos ou outros resultados adversos. Na população geral dos EUA, o risco estimado de antecedentes de defeitos congênitos e aborto nas gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações clínicas
Risco materno e/ou embrionário associado à doença
Em mulheres com evidências de asma mal ou moderadamente controladas, demonstram que há um risco aumentado de pré -eclâmpsia na mãe e o baixo peso ao nascer e pequeno para a idade gestacional no neonato. O nível de controle da asma deve ser monitorado de perto em mulheres grávidas e o tratamento ajustado conforme necessário para manter o controle ideal.
Dados
Dados de animais
Em um estudo aprimorado de toxicidade pré e pós-natal, os macacos grávidas Cynomolgus receberam doses subcutâneas semanais de anticorpo homólogo contra IL-4Rα até 10 vezes o MRHD (em uma base de mg/kg de 100 mg/kg/semana) desde o início da organogênese à parto. Não foram observados efeitos adversos relacionados ao tratamento na toxicidade ou malformações de embrião-fetal ou no desenvolvimento funcional ou imunológico morfológico nos bebês desde o nascimento até os 6 meses de idade.
Lactação
Resumo do risco
Não há dados sobre a presença de dupilumab no leite humano os efeitos no bebê amamentado ou nos efeitos na produção de leite. Sabe -se que a IgG materna está presente no leite humano. Os efeitos da exposição gastrointestinal local e a exposição sistêmica limitada ao dupilumab no bebê amamentado são desconhecidos. Os benefícios de desenvolvimento e saúde da amamentação devem ser considerados juntamente com a necessidade clínica de dupixent da mãe e quaisquer possíveis efeitos adversos na criança amamentada de dupixent ou da condição materna subjacente.
Uso pediátrico
Dermatite atópica
A segurança e a eficácia do dupixent foram estabelecidas em pacientes pediátricos com 6 meses de idade ou mais com anúncio moderado a grave cuja doença não é adequadamente controlada com terapias de prescrição tópica ou quando essas terapias não são aconselháveis [ver [ver Estudos clínicos ].
O uso de dupixent nessa faixa etária é suportado por dados dos seguintes ensaios clínicos:
- AD-1526, que incluiu 251 indivíduos pediátricos de 12 a 17 anos de idade com anúncio moderado de T-Toseve. Dos 251 indivíduos 82 foram tratados com dupixent 200 mg Q2W (<60 kg) or 300 mg Q2W (≥60 kg) e 85 were treated with matching placebo
- AD-1652, que incluiu 367 indivíduos pediátricos 6 a 11 anos de idade com DA grave. Dos 367 indivíduos 120 foram tratados com dupixent 300 mg Q4W TCS (15 para <30 kg) or 200 mg Q2W TCS (≥30 kg) e 123 were treated with matching placebo TCS
- AD-1539, que incluiu 162 indivíduos pediátricos de 6 meses a 5 anos de idade com anúncio moderado a grave. Dos 162 indivíduos 83 foram tratados com dupixent 200 mg Q4W TCS (5 para <15 kg) or 300 mg Q4W TCS (15 to <30 kg) e 79 subjects were assigned to be treated with matching placebo TCS
- AD-1434 Um estudo de extensão de etiqueta aberta que incluiu 275 indivíduos pediátricos 12 a 17 anos tratados com dupixent ± TCS 368 indivíduos pediátricos 6 a 11 anos de idade tratados com dupixent ± TCs e 180 pediatria 6 meses a 5 anos de idade tratados com Dupixent ±
- Liberty-Ad-Haft, que incluiu 27 indivíduos pediátricos de 12 a 17 anos de idade com dermatite atópica com mão moderada a grave e/ou envolvimento do pé tratado com dupixent (n = 14) ou placebo correspondente (n = 13)
A segurança e a eficácia eram geralmente consistentes entre pacientes pediátricos e adultos [ver Reações adversas e Estudos clínicos ]. In addition he-foot-e-mouth disease was reported in 9 (5%) pediatric subjects e skin papilloma was reported in 4 (2%) pediatric subjects 6 months to 5 years of age treated with Dupixent ± TCS in AD-1434. These cases did not lead to study drug discontinuation [see Reações adversas ].
A segurança e a eficácia em pacientes pediátricos com menos de 6 meses de idade com DA não foram estabelecidos.
Asma
A segurança e a eficácia do dupixent para um tratamento de manutenção adicional em pacientes com asma moderada a grave caracterizada por um fenótipo eosinofílico ou com asma dependente de corticosteróide oral foram estabelecidos em pacientes pediátricos com 6 anos de idade e mais. O uso de dupixent para esta indicação é apoiado por evidências de estudos adequados e bem controlados em pacientes adultos e pediátricos com 6 anos ou mais [ver Estudos clínicos ].
Indivíduos pediátricos de 12 a 17 anos de idade
Um total de 107 indivíduos pediátricos de 12 a 17 anos de idade com asma moderada a grave foram inscritos em missão e receberam 200 mg (n = 21) ou 300 mg (n = 18) dupixent (ou placebo correspondente 200 mg [n = 34] ou 300 mg [n = 34]) Q2w. As exacerbações de asma e a função pulmonar foram avaliadas em ambos os indivíduos pediátricos de 12 a 17 anos e adultos. Para as doses de 200 mg e 300 mg de Q2W1 (Mudança média de LS da linha de base na semana 12) foram observadas (0,36 L e 0,27 L, respectivamente). Para os 200 mg de Q2W, os indivíduos tiveram uma redução na taxa de exacerbações graves que eram consistentes com os adultos. A exposição ao dupilumab foi maior nos indivíduos pediátricos de 12 a 17 anos de idade do que em adultos no respectivo nível de dose, que foi explicado principalmente pela diferença de peso corporal [ver Farmacologia Clínica ].
O perfil de eventos adversos em indivíduos pediátricos de 12 a 17 anos de idade era geralmente semelhante aos adultos [ver Reações adversas ].
Indivíduos pediátricos de 6 a 11 anos de idade
Um total de 408 indivíduos pediátricos com 6 a 11 anos de idade com asma moderada a grave foi incluída em viagem que avaliou doses de 100 mg Q2W ou 200 mg Q2W. A melhoria nas exacerbações da asma e na função pulmonar foi demonstrada [ver Estudos clínicos ]. The effectiveness of Dupixent 300 mg Q4W in subjects 6 to 11 years of age with body weight 15 to <30 kg was extrapolated from efficacy of 100 mg Q2W in VIAGEM with support from population pharmacokinetic analyses showing higher drug exposure levels with 300 mg Q4W [see Farmacologia Clínica ]. Subjects who completed the treatment period of the VIAGEM study could participate in the open-label extension study (LTS14424). Eighteen subjects (≥15 to <30 kg) out of 365 subjects were exposed to 300 mg Q4W in this study e the safety profile in these eighteen subjects was consistent with that seen in VIAGEM. Additional safety for Dupixent 300 mg Q4W is based upon available safety information from the pediatric AD indication [see Reações adversas e Farmacologia Clínica ].
A segurança e a eficácia em pacientes pediátricos com menos de 6 anos de idade com asma não foram estabelecidos.
CRSWNP
A segurança e a eficácia do dupixent para tratamento de manutenção adicional em pacientes com rinossinusite crônica controlada inadequadamente com pólipos nasais (CRSWNP) foram estabelecidos em pacientes pediátricos com 12 anos ou mais. O uso de dupixent para esta indicação é apoiado por evidências de estudos adequados e bem controlados de dupixent como tratamento de manutenção adicional em adultos com CRWNP controlado inadequadamente (SINO-24 e Sinus-52) com os seguintes dados adicionais:
- Dados farmacocinéticos (PK) de pacientes adultos e pediátricos com 12 anos ou mais com asma moderada a grave e pacientes adultos com CRSWNP inadequadamente controlado
- Dados de segurança em pacientes pediátricos com 12 anos ou mais com asma moderada a grave [ver Reações adversas Farmacologia Clínica e Estudos clínicos ]
A segurança e a eficácia em pacientes pediátricos com menos de 12 anos de idade com CRWNP não foram estabelecidos.
Eoe
A segurança e a eficácia do dupixent para o tratamento de EOE foram estabelecidas em indivíduos pediátricos com 1 ano de idade e mais com pesagem de pelo menos 15 kg. O uso de dupixent nessa população é apoiado por um estudo adequado bem controlado em adultos e 72 indivíduos pediátricos de 12 a 17 anos de idade (estudo EOE-1) um estudo clínico em 61 indivíduos pediátricos 1 a 11 anos de idade (estudo EOE-2) e dados farmacocinéticos em adultos e pediatria de 1 a 17 anos de idade. A segurança do dupixent em indivíduos pediátricos 1 a 17 anos de idade foi semelhante a adultos [ver Reações adversas Farmacologia Clínica e Estudos clínicos ].
Segurança e eficácia em pacientes pediátricos com menos de 1 ano de idade ou pesando menos de 15 kg com EOE não foram estabelecidos.
Prurigo nodularis
A segurança e a eficácia em pacientes pediátricos com menos de 18 anos de idade com PN não foram estabelecidos.
Doença pulmonar obstrutiva crônica
A segurança e a eficácia em pacientes pediátricos com menos de 18 anos de idade com DPOC não foram estabelecidos. A DPOC é em grande parte uma doença de pacientes adultos.
Urticária espontânea crônica
A segurança e a eficácia do dupixent para o tratamento da CSU em pacientes que permanecem sintomáticas, apesar do tratamento anti -histamínico de H1, foram estabelecidas em pacientes pediátricos com 12 anos de idade ou mais. O uso de dupixent nessa indicação é apoiado por evidências de dois estudos adequados e bem controlados em adultos com dados farmacocinéticos adicionais em 6 pacientes pediátricos 12 anos e mais velhos e dados de segurança em pacientes pediátricos em outras indicações [ver [ver Dosagem e administração Farmacologia Clínica e Estudos clínicos ].
Segurança e eficácia em pacientes pediátricos com menos de 12 anos de idade e/ou pesando menos de 30 kg com CSU não foram estabelecidos.
Uso geriátrico
Dos 1539 indivíduos com anúncio exposto a dupixent em um estudo de dose e ensaios de placebocontrolados, 70 indivíduos eram 65 anos ou mais. Os ensaios clínicos de dupixent na DA não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de maneira diferente de indivíduos mais jovens [ver Farmacologia Clínica ].
Dos indivíduos de 1977 com asma expostos a dupixent, um total de 240 indivíduos era de 65 anos ou mais. A eficácia e a segurança nessa faixa etária foram semelhantes à população geral do estudo.
Dos 440 indivíduos com CRSWNP expostos a Dupixent, um total de 79 indivíduos era de 65 anos ou mais. A eficácia e a segurança nessa faixa etária foram semelhantes à população geral do estudo.
Os estudos clínicos de dupixent em EOE não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de maneira diferente de indivíduos adultos mais jovens.
Dos 152 indivíduos com PN expostos a Dupixent, um total de 37 era de 65 anos ou mais, incluindo 8 indivíduos com 75 anos ou mais. Os ensaios clínicos não incluíram um número suficiente de indivíduos com 65 anos de idade ou mais para determinar se eles respondem de maneira diferente de indivíduos adultos mais jovens.
Dos 1874 indivíduos com DPOC randomizados em ensaios clínicos de dupixent, um total de 1072 era de 65 anos ou mais, enquanto 244 indivíduos tinham 75 anos ou mais. Não foram observadas diferenças gerais na segurança ou eficácia do dupixent entre os indivíduos com 65 anos e indivíduos adultos mais velhos e mais jovens.
Dos 198 indivíduos com CSU expostos a dupixent, um total de 30 indivíduos tinha 65 anos ou mais, incluindo 7 indivíduos com 75 anos ou mais. A eficácia e a segurança nos indivíduos com 65 anos ou mais foram semelhantes à população geral do estudo.
Overdose Informações para dupixent
Não há tratamento específico para overdose dupixent. No caso de overdosage, entre em contato com o controle de veneno (1-800-222-1222) para obter as mais recentes recomendações e monitorar o paciente quanto a quaisquer sinais ou sintomas de reações adversas e instituir o tratamento sintomático apropriado imediatamente.
Contra -indicações para dupixent
Dupixent is contraindicated in patients who have known hypersensitivity to dupilumab or any excipients of Dupixent [see Avisos e precauções ].
Farmacologia Clínica for Dupixent
Mecanismo de ação
O dupilumab é um anticorpo monoclonal humano que inibe a sinalização interleucina-4 (IL-4) e interleucina-13 (IL-13), ligando-se especificamente à subunidade IL-4Rα compartilhada pelos complexos de receptor IL-4 e I-13. O dupilumab inibe a sinalização da IL-4 através do receptor tipo I e da sinalização da IL-4 e da IL-13 através do receptor tipo II.
A inflamação acionada por IL-4 e IL-13 é um componente importante na patogênese da asma ad crswnp EOE PN DPOC e CSU. Múltiplos tipos de células que expressam IL-4Rα (por exemplo, mastócitos Basófilos eosinófilos macrófagos linfócitos células epiteliais células calicéteis) e mediadores inflamatórios (por exemplo, histamina eicosanóides leukotrienes citocinas) estão envolvidas na inflamação. O bloqueio da IL-4Rα com dupilumab inibe as respostas inflamatórias induzidas por IL-4 e IL-13, incluindo a liberação de citocinas pró-inflamatórias quimiocinas óxido nítrico e IgE. O mecanismo de ação do dupilumab não foi definitivamente estabelecido.
Farmacodinâmica
Consistente com a inibição do tratamento com dupilumab de sinalização de IL-4 e IL-13 diminuiu certos biomarcadores da inflamação. Na asma, o óxido nítrico exalado fracionado (FENO) e as concentrações circulantes de alérgenos totais de eotaxina-3 TARC e periostina específicos de IgE foram diminuídos em relação ao placebo. Reduções nesses biomarcadores foram comparáveis para os 300 mg Q2W e 200 mg de regimes Q2W. Esses marcadores estavam próximos da supressão máxima após 2 semanas de tratamento, exceto o IgE, o que diminuiu mais lentamente. Esses efeitos foram sustentados ao longo do tratamento. A redução percentual mediana da linha de base nas concentrações totais de IgE com tratamentos com dupilumab foi de 52% na semana 24 (DRI12544) e 70% na semana 52 (missão). Para o FENO, a redução percentual média da linha de base na semana 2 foi de 35% e 24% no DRI12544 e na missão, respectivamente, e na população geral de segurança, o nível médio de feno diminuiu para 20 ppb.
Um declínio contínuo no IgE total no soro foi observado em ensaios de CSU.
Resposta de anticorpos a vacinas não-vivas durante o tratamento dupixent
Em um estudo clínico, indivíduos adultos com DA foram tratados uma vez por semana por 16 semanas com 300 mg de dupixent (duas vezes a frequência de dosagem recomendada). Após 12 semanas de administração, os indivíduos receberam uma vacina TDAP e uma vacina de polissacarídeo meningocócica. As respostas de anticorpos ao toxóide do tétano e ao polissacarídeo meningocócico de sorogrupo C foram avaliadas 4 semanas depois. As respostas de anticorpos ao polissacarídeo meningococal do toxóide e do sorogrupo C foram semelhantes em indivíduos tratados com dupixent e tratados com placebo. As respostas de anticorpos aos outros componentes ativos de ambas as vacinas não foram avaliados. As respostas de anticorpos a outras vacinas não-vivas também não foram avaliadas.
Lortab é que classe de droga
Farmacocinética
A farmacocinética do dupilumab é semelhante em indivíduos com AD ASMA CRSWNP EOE PN COPD e CSU.
Absorção
Após uma dose inicial subcutânea (SC) de 600 mg de 400 mg ou 300 mg de dupilumab, atingiu as concentrações de média ± DP (CMAX) de 70,1 ± 24,1 mcg/ml 41,8 ± 12,4 mcg/ml ou 30.5 ± 9,39 mcg/ml respectivamente por 1 12,4 mcg/ml ou 30.5 ± 9,39 mcg/ml respectivamente por 1 12,4 por semana 1. As concentrações de estado estacionário foram alcançadas na semana 16 após a administração de 600 mg de dose inicial e 300 mg de dose semanal ou Q2W ou 400 mg de dose inicial e dose de 200 mg Q2W ou 300 mg Q2W sem dose de carga. Nos ensaios clínicos, a média ± DP concentrações de calha no estado estacionário variaram de 55,3 ± 34,3 mcg/ml a 80,2 ± 35,3 mcg/ml para 300 mg administrado Q2W de 173 ± 75,9 mcg/ml a 195 ± 71,7 mcg/ml para 300 mg de administração MCG/ML para 200 mg administrado Q2W.
A biodisponibilidade do dupilumab após uma dose de SC é semelhante entre os indivíduos com AD Asma CRSWNP EOE PN PN e CSU variando entre 61% e 64%.
Distribuição
O volume total estimado de distribuição foi de aproximadamente 4,8 ± 1,3 L.
Eliminação
A via metabólica do dupilumab não foi caracterizada. Como um anticorpo monoclonal humano, o dupilumab deve ser degradado em pequenos peptídeos e aminoácidos por vias catabólicas da mesma maneira que a IgG endógena. Após a última dose de estado estacionário de 300 mg QW 300 mg Q2W 200 mg Q2W 300 mg Q4W ou 200 mg Q4W dupilumab Os tempos medianos para concentração não detectável (<78 ng/mL) ranged from 9 to 13 weeks in adults e pediatric subjects 12 to 17 years of age. Population pharmacokinetic analyses indicate the median times to non-detectable concentration are approximately 1.5 times (up to 19 weeks) e 2.5 times (up to 32 weeks) longer in pediatric subjects 6 to 11 years of age e pediatric subjects 6 months to 5 years of age respectively.
Linearidade da dose
O dupilumab exibiu farmacocinética não linear mediada por alvo, com exposições aumentando de maneira maior que a dose proporcional. A exposição sistêmica aumentou 30 vezes quando a dose aumentou 8 vezes após uma dose única de dupilumab de 75 mg para 600 mg (ou seja, 0,25 vezes a 2 vezes a dose recomendada).
Peso
As concentrações da calha do dupilumab foram menores em indivíduos com maior peso corporal.
Imunogenicidade
O desenvolvimento de anticorpos para o dupilumab foi associado a concentrações séricas de dupilumab mais baixas. Alguns indivíduos que tinham altos títulos de anticorpos também não tinham concentrações de dupilumab séricas detectáveis.
Populações específicas
Idade
Com base na análise farmacocinética da população, a idade não afetou a depuração do dupilumab em adultos e em indivíduos pediátricos com 6 a 17 anos de idade. Em indivíduos pediátricos de 6 meses a 5 anos de folga, a depuração aumentou com a idade.
Pacientes geriátricos
Não foram observadas diferenças gerais na farmacocinética do dupilumab entre indivíduos idosos e mais jovens.
Pacientes pediátricos
Dermatite atópica
Para indivíduos pediátricos de 12 a 17 anos de idade, com o recebimento de anúncios a cada dosagem de 2 semanas (Q2W) com 200 mg (<60 kg) or 300 mg (≥60 kg) the mean ± SD steady-state trough concentration of dupilumab was 54.5±27.0 mcg/mL.
Para indivíduos pediátricos de 6 a 11 anos de idade, com o recebimento de anúncios a cada dosagem de 2 semanas (Q2W) com 200 mg (≥30 kg) ou a cada dosagem de 4 semanas (Q4W) com 300 mg (<30 kg) mean ± SD steady-state trough concentration was 86.0±34.6 mcg/mL e 98.7±33.2 mcg/mL respectively.
Para indivíduos pediátricos de 6 meses a 5 anos de idade, com o recebimento de anúncios a cada dosagem de 4 semanas (Q4W) com 300 mg (≥15 a <30 kg) or 200 mg (≥5 to <15 kg) the mean ± SD steady-state trough concentration was 110±42.8 mcg/mL e 109±50.8 mcg/mL respectively.
Asma
Um total de 107 indivíduos pediátricos de 12 a 17 anos de idade com asma foram matriculados em busca. A média ± DP concentrações de dupilumab em estado estacionário foram 107 ± 51,6 mcg/ml e 46,7 ± 26,9 mcg/ml, respectivamente, para 300 mg ou 200 mg administrado Q2W.
Na Voyage, o dupilumab farmacocinética foi investigado em 270 indivíduos com asma moderada de T-Tosevere após administração subcutânea de 100 mg de Q2W (para 91 indivíduos pediátricos pesando <30 kg) or 200 mg Q2W (for 179 pediatric subjects weighing ≥30 kg). The mean ± SD steady-state trough concentration was 58.4±28.0 mcg/mL e 85.1±44.9 mcg/mL respectively. Simulation of a 300 mg Q4W subcutaneous dose in pediatric subjects 6 to 11 years of age with body weight of ≥15 to <30 kg resulted in predicted steady-state trough concentrations (98.7±41.0 mcg/mL) e average concentrations higher than the observed trough concentrations e average concentrations of 100 mg Q2W (<30 kg).
CRSWNP
Estudos clínicos não foram realizados em pacientes pediátricos com 12 anos ou mais com CRWNP. Espera -se que as exposições de dupilumab sejam comparáveis entre adultos e pacientes pediátricos com 12 anos ou mais na dosagem recomendada para CRSWNP (300 mg a cada 2 semanas).
Esofagite eosinofílica
No estudo, a farmacocinética do dupilumab EOE-1 foi investigada em 35 indivíduos pediátricos de 12 a 17 anos de idade pesando pelo menos 40 kg com EOE recebendo 300 mg de QW. A média da concentração média de dupilumab foi de 227 ± 95,3 mcg/ml.
No estudo, o EOE-2 Parte A Dupilumab Pharmacocinetics foi investigado em 20 indivíduos pediátricos 1 a 11 anos de idade, com EOE recebendo os seguintes regimes de dosagem baseados em peso: ≥15 a <30 kg (200 mg Q2W) e ≥30 to <40 kg (300 mg Q2W). At Week 16 the mean ± SD steady-state trough concentration of dupilumab was 174±66.2 mcg/mL.
A exposição sistêmica em indivíduos pediátricos 1 a 11 anos de idade com peso corporal ≥40 kg que recebe 300 mg de QW deve ser comparável a indivíduos adultos e pediátricos com 12 anos ou mais com peso corporal ≥40 kg. A exposição sistêmica em indivíduos pediátricos de 12 a 17 anos de idade com peso corporal <40 kg receiving 300 mg Q2W is expected to be comparable to pediatric subjects 6 to 11 years of age.
Urticária espontânea crônica
Um total de 12 indivíduos pediátricos de 12 a 17 anos de idade com CSU foram matriculados no Cupido. As concentrações de calha no estado estacionário observadas de 6 indivíduos pediátricos de 12 a 17 anos de idade com a CSU que receberam dupixent 300 mg Q2W ou 200 mg Q2W estavam dentro da faixa de concentrações da calha de estados estacionários em indivíduos adultos com CSU que receberam Dupixent 300 mg Q2W.
Estudos de interação medicamentosa
Não é esperado um efeito do dupilumab no PK de medicamentos co-administrados. Com base na análise populacional, geralmente co-administrava os medicamentos não teve efeito na farmacocinética dupixent em indivíduos com asma moderada a grave.
Substratos do citocromo p450
The effects of dupilumab on the pharmacokinetics of midazolam (metabolized by CYP3A4) warfarin (metabolized by CYP2C9) omeprazole (metabolized by CYP2C19) metoprolol (metabolized by CYP2D6) and caffeine (metabolized by CYP1A2) were evaluated in a study with 12-13 evaluable subjects with AD (a Dose de carregamento de SC de 600 mg, seguido de 300 mg SC semanalmente por seis semanas). Não foram observadas alterações clinicamente significativas na AUC. O maior efeito foi observado para o metoprolol (CYP2D6) com um aumento na AUC de 29%.
Imunogenicidade
A incidência observada de anticorpos antidrogas é altamente dependente da sensibilidade e especificidade do ensaio. As diferenças nos métodos de ensaio impedem comparações significativas da incidência de anticorpos antidrogas nos estudos descritos abaixo com a incidência de anticorpos antidrogas em outros estudos, incluindo os de dupixent ou outros produtos de dupilumab.
Dermatite atópica
Aproximadamente 6% dos indivíduos com DA que receberam dupixent 300 mg Q2W por 52 semanas desenvolveram anticorpos para dupixent; Aproximadamente 2% exibiram respostas persistentes da ADA e aproximadamente 1% apresentaram anticorpos neutralizantes. Resultados semelhantes foram observados em indivíduos pediátricos de 6 meses a 11 anos de idade com DA que receberam dupixent 200 mg Q2W 200 mg Q4W ou 300 mg Q4W.
Aproximadamente 16% dos indivíduos pediátricos de 12 a 17 anos de idade com DA que receberam dupixent 300 mg ou 200 mg Q2W por 16 semanas desenvolveram anticorpos para dupixent; Aproximadamente 3% exibiram respostas persistentes da ADA e aproximadamente 5% apresentaram anticorpos neutralizantes.
Asma
Aproximadamente 5% dos indivíduos com asma que receberam dupixent 300 mg Q2W por 52 semanas desenvolveram anticorpos para dupixent; Aproximadamente 2% exibiram respostas persistentes da ADA e aproximadamente 2% apresentaram anticorpos neutralizantes. Resultados semelhantes foram observados em indivíduos pediátricos de 6 a 11 anos de idade com asma que receberam dupixent 100 mg Q2W ou 200 mg Q2W até 52 semanas.
Aproximadamente 9% dos indivíduos com asma que receberam dupixent 200 mg Q2W por 52 semanas desenvolveram anticorpos para dupixent; Aproximadamente 4% exibiram respostas persistentes da ADA e aproximadamente 4% apresentaram anticorpos neutralizantes.
Rinossinusite crônica com pólipos nasais
Aproximadamente 5% dos indivíduos adultos com CRWNP que receberam dupixent 300 mg Q2W por 52 semanas desenvolveram anticorpos para dupixent; Aproximadamente 2% exibiram respostas persistentes da ADA e aproximadamente 3% apresentaram anticorpos neutralizantes.
Esofagite eosinofílica
Aproximadamente 1% dos indivíduos com EOE que receberam dupixent 300 mg QW por 52 semanas desenvolveram anticorpos para dupixent; Nenhum sujeito exibiu respostas persistentes da ADA ou teve anticorpos neutralizantes. Resultados semelhantes foram observados em indivíduos pediátricos 1 a 11 anos de idade com EOE administrado com Dupixent 200 mg Q2W ou 300 mg Q2W por 52 semanas.
Prurigo nodularis
Aproximadamente 8% dos indivíduos com PN que receberam dupixent 300 mg Q2W por 24 semanas desenvolveram anticorpos para dupixent; Aproximadamente 1% exibiram respostas persistentes da ADA e aproximadamente 3% apresentaram anticorpos neutralizantes.
Doença pulmonar obstrutiva crônica
Aproximadamente 8% dos indivíduos com DPOC que receberam dupixent 300 mg Q2W por 52 semanas desenvolveram anticorpos para dupixent; Aproximadamente 3% exibiram respostas persistentes da ADA e aproximadamente 3% apresentaram anticorpos neutralizantes.
Urticária espontânea crônica
Aproximadamente 5% dos indivíduos com CSU que receberam dupixent 200 mg Q2W ou 300 mg Q2W através de 24 semanas desenvolveram anticorpos para dupilumab; Aproximadamente 1% exibiram respostas persistentes da ADA e aproximadamente 1% apresentaram anticorpos neutralizantes.
Os títulos de anticorpos detectados em indivíduos que receberam dupixent eram principalmente baixos. Em indivíduos que receberam o desenvolvimento de dupixent de anticorpos altos de título para dupixent, foi associado a concentrações de dupilumab séricas mais baixas [ver Farmacologia Clínica ].
Dois indivíduos adultos com AD que experimentaram respostas de anticorpos de alto título desenvolveram doenças séricas ou reações de doença sérica durante a terapia dupixent [ver Avisos e precauções ].
Estudos clínicos
Dermatite atópica
Adultos com dermatite atópica
Três estudos randomizados controlados por placebo duplo randomizado (Solo 1 (NCT02277743) Solo 2 (NCT02277769) e Chronos (NCT02260986) incluíram um total de 2119 disciplinas adultas 18 anos de idade e mais antiga com moderação e severa advertemente advertidamente. A gravidade da doença foi definida pela pontuação da avaliação global de um investigador (IGA) ≥3 na avaliação geral das lesões de anúncios em uma escala de gravidade de 0 a 4 uma área de área de eczema e índice de gravidade (EASI) ≥16 em uma escala de 0 a 72 e uma área de superfície corporal mínima envolvimento de ≥10%. Na linha de base, 59% dos indivíduos eram 67% do sexo masculino, 52% dos indivíduos tinham uma pontuação de IgA basal de 3 (DA moderada) e 48% dos indivíduos tinham uma IgA basal de 4 (DA grave). A pontuação média do EASI da linha de base foi de 33 e a escala de classificação Numeric de pico de pico de média semanal (NRS) foi de 7 em uma escala de 0 a 10.
Nos três ensaios, os indivíduos no grupo dupixent receberam injeções subcutâneas de dupixent 600 mg na semana 0, seguidas de 300 mg a cada 2 semanas (Q2W). Nos ensaios de monoterapia (solo 1 e solo 2), os indivíduos receberam dupixent ou placebo por 16 semanas.
No ensaio concomitante de terapia (cronos), os indivíduos receberam dupixent ou placebo com corticosteróides tópicos concomitantes (TCs) e, conforme necessário, inibidores de calcineurina tópicos para áreas problemáticas apenas, como as áreas intertiginosas e genitais do pescoço de face por 52 semanas.
Todos os três ensaios avaliaram o endpoint primário da alteração da linha de base para a semana 16 na proporção de indivíduos com um IgA 0 (claro) ou 1 (quase claro) e pelo menos uma melhoria de 2 pontos. Outros pontos de extremidade incluíram a proporção de indivíduos com EASI-75 (melhora de pelo menos 75% na pontuação do EASI em relação à linha de base) e redução na coceira, conforme definido por pelo menos uma melhoria de 4 pontos no pico de NRS da linha de base para a semana 16.
Resposta clínica na semana 16 (Solo 1 Solo 2 e Chronos)
Os resultados dos ensaios de monoterapia com dupixent (Solo 1 e Solo 2) e o dupixent com estudo concomitante de TCS (Chronos) são apresentados na Tabela 14.
Tabela 14: Resultados de eficácia do dupixent com ou sem TCs concomitantes na semana 16 (FAS) em indivíduos adultos com 18 anos de idade ou mais com anúncio moderado a grave
| Apenas 1 | Apenas 2 | Chronos | ||||
| Dupixent 300 mg Q2W | Placebo | Dupixent 300 mg Q2W | Placebo | Dupixent 300 mg Q2W TCS | Placebo TCS | |
| Número de indivíduos randomizados (FAs)a | 224 | 224 | 233 | 236 | 106 | 315 |
| IGA 0 ou 1bc | 38% | 10% | 36% | 9% | 39% | 12% |
| Enterprise Estoniac | 51% | 15% | 44% | 12% | 69% | 23% |
| Enterprise Estoniac | 36% | 8% | 30% | 7% | 40% | 11% |
| Número de indivíduos com pontuação NRS de pruritus de pico de linha de base ≥4 | 213 | 212 | 225 | 221 | 102 | 299 |
| NRS de prurido de pico (melhoria ≥4 pontos)c | 41% | 12% | 36% | 10% | 59% | 20% |
| a O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados. b O respondente foi definido como um sujeito com um IgA 0 ou 1 (claro ou quase claro) e uma redução de ≥2 pontos em uma escala de 0-4 IgA. c Os indivíduos que receberam tratamento de resgate ou com dados ausentes foram considerados não respondedores. |
Figura 1: Proporção de indivíduos adultos com 18 anos de idade ou mais com DA moderada a grave com melhoria ≥4 pontos no pico de prurido NRS no solo 1a e Apenas 2a Estudos (FAS)b
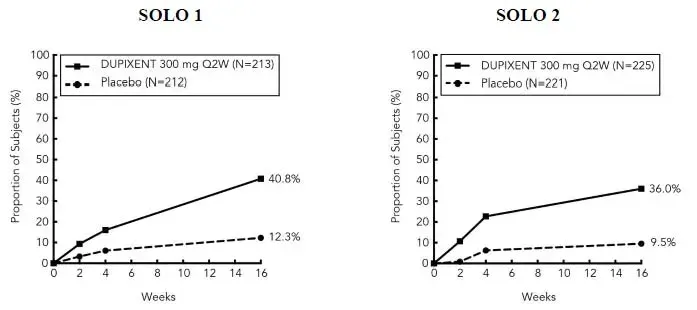 |
a Nas análises primárias dos endpoints de eficácia, os indivíduos que receberam tratamento de resgate ou com dados ausentes foram considerados não respondedores.
b O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados.
Nos cronos dos 421 indivíduos, 353 estavam em estudo por 52 semanas no momento da análise de dados. Desses 353 indivíduos, os respondentes na semana 52 representam uma mistura de indivíduos que mantiveram sua eficácia a partir da semana 16 (por exemplo, 53% do Dupixent IgA 0 ou 1 respondentes na semana 16 permaneceram respondedores na semana 52) e os indivíduos não respondiam na semana 16 que não responderam à semana que não responderam mais tarde (por exemplo, 24% de 52) e que não respondiam na semana 16 ou que não respondiam (por exemplo, 52, em 52) e que não respondiam na semana. Os resultados de análises de suporte dos 353 indivíduos no dupixent com o estudo concomitante de TCS (Chronos) são apresentados na Tabela 15.
Tabela 15: Resultados da eficácia (IgA 0 ou 1) de dupixent com TCs concomitantes na semana 16 e 52 em indivíduos adultos com 18 anos de idade ou mais com anúncio moderado a grave
| Dupixent 300 mg Q2W TCS | Placebo TCS | |
| Número de sujeitosa | 89 | 264 |
| ResponderBC nas semanas 16 e 52 | 22% | 7% |
| Respondente na semana 16, mas não responde na semana 52 | 20% | 7% |
| Não-respondente na semana 16 e respondente na semana 52 | 13% | 6% |
| Não-resumo nas semanas 16 e 52 | 44% | 80% |
| Respondente geralbc Taxa na semana 52 | 36% | 13% |
| a Nos cronos dos 421 indivíduos randomizados e tratados, 68 indivíduos (16%) não estavam em estudo por 52 semanas no momento da análise de dados. b O respondente foi definido como um sujeito com um IgA 0 ou 1 (claro ou quase claro) e uma redução de ≥2 pontos em uma escala de 0-4 IgA. c Os indivíduos que receberam tratamento de resgate ou com dados ausentes foram considerados não respondedores. |
Efeitos do tratamento em subgrupos (raça de gênero na idade do peso e tratamento prévio, incluindo imunossupressores) em solo 1 solo 2 e cronos foram geralmente consistentes com os resultados na população geral do estudo.
Em Solo 1 Solo 2 e Chronos, um terceiro braço de tratamento randomizado de dupixent 300 mg QW não demonstrou benefício adicional de tratamento sobre dupixent 300 mg Q2W.
Os indivíduos em Solo 1 e Solo 2, que tiveram um IgA 0 ou 1 com uma redução de ≥2 pontos, foram reerominados no Solo Continuar (NCT02395133). Solo Continuar avaliou vários regimes de dose de monoterapia com dupixent para manter a resposta ao tratamento. O estudo incluiu indivíduos randomizados para continuar com dupixent 300 mg Q2W (62 indivíduos) ou mudar para placebo (31 indivíduos) por 36 semanas. As respostas IGA 0 ou 1 na semana 36 foram as seguintes: 33 (53%) no grupo Q2W e 3 (10%) no grupo placebo.
Indivíduos pediátricos de 12 a 17 anos de idade com dermatite atópica
A eficácia da monoterapia com dupixent em indivíduos pediátricos de 12 a 17 anos foi avaliada em um estudo controlado por placebo duplo randomizado multicêntrico (AD-1526; NCT03054428) em sconge (Scone 3 de ≥ `Scone of 3) em Scon Scone (2 PELATE (SPOLE DO (SCOLDA DO (SCOLDA DO (SCOLDA DO 3 ° 0 a 72) e um envolvimento mínimo da BSA ≥10%. Os sujeitos elegíveis inscritos neste estudo tiveram resposta inadequada anterior à medicação tópica.
Assuntos do grupo dupixent com peso de linha de base de <60 kg received an initial dose of 400 mg at Week 0 followed by 200 mg Q2W for 16 weeks. Subjects with baseline weight of ≥60 kg received an initial dose of 600 mg at Week 0 followed by 300 mg Q2W for 16 weeks. Subjects were permitted to receive rescue treatment at the discretion of the investigator. Subjects who received rescue treatment were considered non-responders.
No AD-1526, a idade média foi de 14,5 anos, o peso médio era de 59,4 kg, 41% dos indivíduos eram do sexo feminino, 63% eram brancos 15% eram asiáticos e 12% eram negros. Na linha de base, 46% dos indivíduos tinham uma pontuação de IgA de 3 (AD moderada) 54% tinham uma pontuação de IgA de 4 (DA grave). O envolvimento médio da BSA foi de 57% e 42% receberam imunossupressores sistêmicos anteriores. Também na linha de base, a pontuação média do EASI foi de 36 e o pico de pico de média semanal NRS foi de 8 em uma escala de 0 a 10. No geral, 92% dos indivíduos tinham pelo menos uma condição alérgica comórida; 66% tinham rinite alérgica 54% tinham asma e 61% tinham alergias alimentares.
O endpoint primário foi a proporção de indivíduos com um IgA 0 (claro) ou 1 (quase claro) e pelo menos uma melhoria de 2 pontos da linha de base para a semana 16. Outros resultados avaliados incluíram a proporção de indivíduos com EASI-75 ou EASI-90 (melhoria de ITCH de MEDIDA de MEDEIRO DO PEASIO DO EASIO DO PEASIO DO EASIO) e REDUÇÃO EM REDUÇÃO EM MEDIDAS DO PEASIO DE PEASI) e REDUÇÃO EM REDUÇÃO DO ATENSIO DE PEASI) e REDUMA) e (REDCH).
Os resultados da eficácia na semana 16 para o AD-1526 são apresentados na Tabela 16.
Tabela 16: Resultados da eficácia do dupixent no AD-1526 na semana 16 (FAS)a Em indivíduos pediátricos de 12 a 17 anos de idade com anúncio moderado a grave
| Dupixentd 200 mg (<60 kg) or 300 mg (≥60 kg) Q2W N = 82a | Placebo N = 85a | |
| IGA 0 ou 1bc | 24% | 2% |
| Enterprise Estoniac | 42% | 8% |
| Enterprise Estoniac | 23% | 2% |
| NRS de prurido de pico (melhoria de 4 pontos)c | 37% | 5% |
| a O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados. b O respondente foi definido como um sujeito com um IgA 0 ou 1 (claro ou quase claro) e uma redução de ≥2 pontos em uma escala de 0-4 IgA. c Os indivíduos que receberam tratamento de resgate ou com dados ausentes foram considerados não respondedores (59% e 21% nos braços placebo e dupixent, respectivamente). d Na semana 0, os sujeitos receberam 400 mg (peso da linha de base <60 kg) or 600 mg (baseline weight ≥60 kg) of Dupixent. |
Uma proporção maior de indivíduos randomizados para o dupixent alcançou uma melhora no pico de NRS de prurritus em comparação com o placebo (definido como melhoria de ≥4 pontos na semana 4). Veja a Figura 2.
Figura 2: Proporção de indivíduos pediátricos de 12 a 17 anos de idade com DA moderada a grave com melhoria de ≥4 pontos no pico de NRS no AD-1526a (FAS)b
 |
a Nas análises primárias dos endpoints de eficácia, os indivíduos que receberam tratamento de resgate ou com dados ausentes foram considerados não respondedores.
b O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados.
Indivíduos pediátricos 6 a 11 anos de idade com dermatite atópica
The efficacy and safety of DUPIXENT use concomitantly with TCS in pediatric subjects was evaluated in a multicenter randomized double-blind placebo-controlled trial (AD-1652; NCT03345914) in 367 subjects 6 to 11 years of age with AD defined by an IGA score of 4 (scale of 0 to 4) an EASI score ≥21 (scale of 0 to 72) and a minimum Envolvimento da BSA ≥15%. Os sujeitos elegíveis inscritos neste estudo tiveram resposta inadequada anterior à medicação tópica. A inscrição foi estratificada pelo peso da linha de base (<30 kg; ≥30 kg).
Os indivíduos do grupo Dupixent Q4W TCS receberam uma dose inicial de 600 mg no dia 1, seguida de 300 mg Q4W da semana 4 à semana 12, independentemente do peso. Assuntos do grupo Dupixent Q2W TCS com peso de linha de base de <30 kg received an initial dose of 200 mg on Day 1 followed by 100 mg Q2W from Week 2 to Week 14 e subjects with baseline weight of ≥30 kg received an initial dose of 400 mg on Day 1 followed by 200 mg Q2W from Week 2 to Week 14. Subjects were permitted to receive rescue treatment at the discretion of the investigator. Subjects who received rescue treatment were considered non-responders.
No AD-1652, a idade média foi de 8,5 anos, o peso médio foi de 29,8 kg, 50% dos indivíduos eram do sexo feminino, 69% eram brancos 17% eram pretos e 8% eram asiáticos. Na linha de base, o envolvimento médio da BSA foi de 58% e 17% recebeu imunossupressores não esteróides sistêmicos anteriores. Também na linha de base, a pontuação média do EASI foi de 37,9 e a média semanal da pior pontuação diária da coceira foi de 7,8 em uma escala de 0 a 10. No geral, 92% dos indivíduos tinham pelo menos uma condição alérgica comórida; 64% tinham alergias alimentares 63% tinham outras alergias 60% tinham rinite alérgica e 47% tinham asma.
O endpoint primário foi a proporção de indivíduos com um IgA 0 (claro) ou 1 (quase claro) na semana 16. Outros resultados avaliados incluíram a proporção de indivíduos com EASI-75 ou Easireference 90 (melhora de pelo menos 75 ou 90% no EASI do basal, respectivamente) e redução na medida em que medidos por pico.
A Tabela 17 apresenta os resultados por estratos de peso da linha de base para os regimes de dose aprovados.
Xanax vs Lorazepam, o que é mais forte
Tabela 17: Resultados da eficácia do dupixent com TCs concomitantes no AD-1652 na semana 16 (FAS)a em indivíduos pediátricos de 6 a 11 anos de idade com anúncio
| Dupixent 300 mg Q4Wd TCS (N = 61) <30 kg | Placebo TCS (N = 61) <30 kg | Dupixent 200 mg Q2We TCS (N = 59) ≥30 kg | Placebo TCS (N = 62) ≥30 kg | |
| IGA 0 ou 1bc | 30% | 13% | 39% | 10% |
| Enterprise Estoniac | 75% | 28% | 75% | 26% |
| Enterprise Estoniac | 46% | 7% | 36% | 8% |
| NRS de prurido de pico (melhoria ≥4 pontos)c | 54% | 12% | 61% | 13% |
| a O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados. b O respondente foi definido como um sujeito com um IgA 0 ou 1 (claro ou quase claro). c Os indivíduos que receberam tratamento de resgate ou com dados ausentes foram considerados não respondedores. d No dia 1, os sujeitos receberam 600 mg de dupixent. e No dia 1, os sujeitos receberam 200 mg (peso da linha de base <30 kg) or 400 mg (baseline weight ≥30 kg) of Dupixent. |
Uma proporção maior de indivíduos randomizados para DUPIXENT TCS alcançou uma melhora no pico de NRS de prurritus em comparação com os TCs de placebo (definidos como melhoria ≥4 pontos na semana 16). Veja a Figura 3.
Figura 3: Proporção de indivíduos pediátricos de 6 a 11 anos de idade com DA com melhoria de ≥4 pontos no pico de prurido NRS na semana 16 no AD-1652a (FAS)b
 |
a Nas análises primárias dos endpoints de eficácia, os indivíduos que receberam tratamento de resgate ou com dados ausentes foram considerados não respondedores.
b O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados.
Indivíduos pediátricos de 6 meses a 5 anos com dermatite atópica
The efficacy and safety of DUPIXENT use concomitantly with TCS in pediatric subjects was evaluated in a multicenter randomized double-blind placebo-controlled trial (AD-1539; NCT03346434) in 162 subjects 6 months to 5 years of age with moderate-to-severe AD defined by an IGA score ≥3 (scale of 0 to 4) an EASI score ≥16 (scale of 0 a 72) e um envolvimento mínimo da BSA ≥10%. Os sujeitos elegíveis inscritos neste estudo tiveram resposta inadequada anterior à medicação tópica. A inscrição foi estratificada pelo peso da linha de base (≥5 para <15 kg e ≥15 to <30 kg).
Indivíduos no grupo dupixent q4w tcs com peso basal ≥5 a <15 kg received an initial dose of 200 mg on Day 1 followed by 200 mg Q4W from Week 4 to Week 12 e subjects with baseline weight of ≥15 to <30 kg received an initial dose of 300 mg on Day 1 followed by 300 mg Q4W from Week 4 to Week 12. Subjects were permitted to receive rescue treatment at the discretion of the investigator. Subjects who received rescue treatment were considered non-responders.
No AD-1539, a idade média foi de 3,8 anos, o peso médio era de 16,5 kg 39% dos indivíduos eram do sexo feminino, 69% eram brancos 19% eram pretos e 6% eram asiáticos. Na linha de base, o envolvimento médio da BSA foi de 58% e 29% dos indivíduos receberam imunossupressores sistêmicos anteriores. Também na linha de base, a pontuação média do EASI foi de 34,1 e a média semanal da pior pontuação diária de arranhões/coceira foi de 7,6 em uma escala de 0 a 10. No geral, 81,4% dos indivíduos tinham pelo menos uma condição alérgica comórbida; 68,3% tinham alergias alimentares 52,8% tinham outras alergias 44,1% tinham rinite alérgica e 25,5% tinham asma.
O endpoint primário foi a proporção de indivíduos com um IgA 0 (claro) ou 1 (quase claro) na semana 16. Outros resultados avaliados incluíram a proporção de indivíduos com EASI-75 ou EASI-90 (melhoria de pelo menos 75% ou 90% no EASI da linha de linha de base) e a redução da ITCINT como medida pelo pior arranhão/ITCH NRS (≥-Ponte (≥-PoInt) e ≥-Point.
Os resultados da eficácia na semana 16 para o AD-1539 são apresentados na Tabela 18.
Tabela 18: Resultados da eficácia do dupixent com TCs concomitantes no AD-1539 na semana 16 (FAS)a Em indivíduos pediátricos de 6 meses a 5 anos de idade com anúncio moderado e grave
| Dupixent TCS 200 mg (5 to <15 kg) or 300 mg (15 to <30 kg) Q4Wd (N = 83)a | Placebo TCS (N = 79)a | Diferença vs. placebo (IC 95 %) | |
| IGA 0 ou 1bc | 28% | 4% | 24% (13% 34%) |
| Enterprise Estoniac | 53% | 11% | 42% (29% 55%) |
| Enterprise Estoniac | 25% | 3% | 23% (12% 33%) |
| Pior Scratch/Itch NRS (Melhorias ≥4 pontos)c | 48% | 9% | 39% (26% 52%) |
| CI = intervalo de confiança a O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados. b O respondente foi definido como um sujeito com um IgA 0 ou 1 (claro ou quase claro). c Os indivíduos que receberam tratamento de resgate (63% e 19% nos braços placebo e dupixent, respectivamente) ou com dados ausentes foram considerados como não respondedores. d No dia 1, os sujeitos receberam 200 mg (5 para <15 kg) or 300 mg (15 to <30 kg) of Dupixent. |
Dermatite atópica With He And/Ou Foot Involvement
The efficacy and safety of DUPIXENT was evaluated in a 16-week multicenter randomized double-blind parallel-group placebo-controlled trial (Liberty-AD-HAFT; NCT04417894) in 133 adult and pediatric subjects 12 to 17 years of age with atopic dermatitis with moderate-tosevere hand and/or foot involvement defined by an established diagnosis of atopic dermatitis and screening to rule Dermatite de contato irritante e alérgica por meio da história e teste de adesivo apropriado e por uma pontuação de IgA (mão e pé) ≥3 (escala de 0 a 4) e uma escala de classificação numérica de prurido e pesa de mão e pé (NRS) para intensidade máxima da ITCH ≥4 (escala de 0 a 10). Cinqüenta e três (53) por cento (n = 70/133) dos sujeitos também apresentaram anúncio moderado a grave fora das mãos ou pés (IGA global ≥3). Os indivíduos elegíveis apresentaram resposta ou intolerância inadequada anterior ao tratamento da dermatite manual e/ou pé com medicamentos tópicos de anúncios. Neste julgamento, 67 indivíduos receberam dupixent e 66 indivíduos receberam placebo. Os indivíduos tratados com dupixent receberam a dosagem recomendada com base em sua idade e peso corporal [ver Dosagem e administração ]. Subjects were not allowed concomitant use of topical treatments for AD on the hes e feet during the trial but were allowed the use of topical treatments for AD on other parts of the body with certain restrictions.
Em Liberty-Ad-Haft, 38% dos indivíduos eram do sexo masculino, 80% eram brancos 13% eram asiáticos e 5% eram negros ou afro-americanos. Para etnia, 4% foram identificados como hispânicos ou latinos e 96% foram identificados como não hispânicos ou latinos. Setenta e dois (72) por cento (n = 96/133) dos indivíduos tiveram uma pontuação de IgA basal (mão e pé) de 3 (dermatite atópica com envolvimento moderado à mão e/ou pé) e 28% (n = 37/133) de indivíduos com a linhagem e a pontuação da mão e do pé) (n = 37/133) com a pontuação severa e do pé/pé) (n = 37/133) com a pontuação severida e do pé/pé) (n = 37/133) com a pontuação de oda e pé de manual e pé). A pontuação semanal da linha semanal e a pontuação do NRS de prurritus de pico de pico foi de 7,1.
O endpoint primário foi a proporção de indivíduos com uma pontuação de Mão e Pé de IgA de 0 (clara) ou 1 (quase clara) na semana 16. O ponto final secundário principal foi a redução da coceira, conforme medido pelo NRS do prurido de pico da mão e do pé (melhoria de ≥4 pontos).
Os resultados da eficácia na semana 16 para Liberty-Ad-Haft são apresentados na Tabela 19.
Tabela 19: Resultados da eficácia do dupixent em Liberty-Ad-Haft na semana 16 (FAS) A em indivíduos adultos e pediátricos de 12 a 17 anos de idade com DA com manual e/ou envolvimento de pés graves e modernos
| Dupixent 200/300 mg Q2Wd (N = 67)a | Placebo (N = 66)a | Diferença vs. placebo (IC 95 %) | |
| IgA (mão e pé) 0 ou 1bc | 40% | 17% | 24% (9% 38%) |
| Melhoria (redução) de prurritus de mão e pico médias semanais NRS ≥4c | 52% | 14% | 39% (24% 53%) |
| CI = intervalo de confiança a O conjunto completo de análises (FAs) inclui todos os sujeitos randomizados. b O respondente foi definido como um sujeito com um IgA 0 ou 1 (claro ou quase claro). c Os indivíduos que receberam tratamento de resgate (21% e 3% nos braços placebo e dupixent, respectivamente) ou com dados ausentes foram considerados como não respondedores. d Os adultos receberam uma dose de carregamento de dupixent 600 mg SC, seguido de 300 mg de SC Q2W. Os indivíduos pediátricos de 12 a 17 anos receberam uma dose de carregamento de dupixent 600 mg sc, seguido de 300 mg sc q2w (para peso corporal ≥60 kg) ou uma dose de carga de dupixent 400 mg sc, seguido por 200 mg sc q2w (para peso corporal <60 kg). |
Asma
O programa de desenvolvimento da asma para pacientes com 12 anos ou mais incluiu três ensaios multicêntricos de grupo paralelo controlados por placebo duplo duplo (DRI12544 â<1.3%) were excluded. Dupixent was administered as add-on to background asthma treatment. Subjects continued background asthma therapy throughout the duration of the studies except in RISCO in which OCS dose was tapered as described below.
DRI12544
DRI12544 was a 24-week dose-ranging study which included 776 adult subjects (18 years of age e older). Dupixent compared with placebo was evaluated in adult subjects with moderateto-severe asthma on a medium or high-dose inhaled corticosteroid e a long acting beta agonist. Subjects were reomized to receive either 200 mg (N=150) or 300 mg (N = 157) Dupixent every 2 weeks (Q2W) or 200 mg (N=154) or 300 mg (N = 157) Dupixent every 4 weeks following an initial dose of 400 mg 600 mg or placebo (N=158) respectively. The primary endpoint was mean change from baseline to Week 12 in FEV1 (L) em indivíduos com eosinófilos sanguíneos da linha de base ≥300 células/MCL. Outros pontos de extremidade incluíram alteração percentual em relação à linha de base no FEV1 e annualized rate of severe asthma exacerbation events during the 24-week placebo-controlled treatment period. Results were evaluated in the overall population e subgroups based on baseline blood eosinophil count (≥300 cells/mcL e <300 cells/mcL). Additional secondary endpoints included responder rates in the patient reported Asma Control Questionnaire (ACQ- 5) e Asma Quality of Life Questionnaire Steardized Version (AQLQ(S)) scores.
BUSCA
BUSCA was a 52-week study which included 1902 adult e pediatric subjects (12 years of age e older). Dupixent compared with placebo was evaluated in 107 pediatric subjects 12 to 17 years of age e 1795 adult subjects with moderate-to-severe asthma on a medium or high-dose inhaled corticosteroid (ICS) e a minimum of one e up to two additional controller medications. Subjects were reomized to receive either 200 mg (N=631) or 300 mg (N=633) Dupixent Q2W (or matching placebo for either 200 mg [N=317] or 300 mg [N = 321] Q2W) following an initial dose of 400 mg 600 mg or placebo respectively. The primary endpoints were the annualized rate of severe exacerbation events during the 52-week placebo-controlled period e change from baseline in pre-bronchodilator FEV1 Na semana 12, na população geral (sem restrições por contagem mínima de eosinófilos no sangue da linha de base). Os pontos de extremidade secundários adicionais incluíram taxas de exacerbação graves anualizadas e FEV1 Em indivíduos com diferentes níveis basais de eosinófilos sanguíneos, bem como as taxas de resposta nas pontuações ACQ-5 e AQLQ (s).
RISCO
RISCO was a 24-week oral corticosteroid-reduction study in 210 adult e pediatric subjects 15 years of age e older with asthma who required daily oral corticosteroids in addition to regular use of high dose inhaled corticosteroids plus an additional controller. After optimizing the OCS dose during the screening period subjects received 300 mg Dupixent (N=103) or placebo (N=107) once Q2W for 24 weeks following an initial dose of 600 mg or placebo. Subjects continued to receive their existing asthma medicine during the study; however their OCS dose was reduced every 4 weeks during the OCS reduction phase (Week 4-20) as long as asthma control was maintained. The primary endpoint was the percent reduction of oral corticosteroid dose at Weeks 20 to 24 compared with the baseline dose while maintaining asthma control in the overall population (unrestricted by minimum baseline blood eosinophils count). Additional secondary endpoints included the annualized rate of severe exacerbation events during treatment period e responder rate in the ACQ-5 e AQLQ(S) scores.
As características demográficas e basais desses três ensaios são fornecidas na Tabela 20 abaixo.
Tabela 20: Demografia e características de base dos ensaios de asma
| Parâmetro | DRI12544 (N = 776) | BUSCA (N = 1902) | RISCO (N = 210) |
| Idade média (anos) (DP) | 49 (13) | 48 (15) | 51 (13) |
| % Fêmea | 63 | 63 | 61 |
| % Branco | 78 | 83 | 94 |
| Duração da média da asma (anos) (± DP) | 22 (15) | 21 (15) | 20 (14) |
| Nunca fumado (%) | 77 | 81 | 81 |
| Exacerbações médias no ano anterior (± DP) | 2.2 (2.1) | 2.1 (2.2) | 2.1 (2.2) |
| Uso de ICs de alta dose (%) | 50 | 52 | 89 |
| FEV pré-dose1 (L) na linha de base (± DP) | 1,84 (0,54) | 1,78 (0,60) | 1,58 (0,57) |
| Percentual média de FEVI previsto na linha de base (%) (± DP) | 61 (11) | 58 (14) | 52 (15) |
| % Reversibilidade (± DP) | 27 (15) | 26 (22) | 19 (23) |
| Histórico médico atópico % geral (AD % NP % AR %) | 73 (8 11 62) | 78 (10 13 69) | 72 (8 21 56) |
| FenO ppb médio (± DP) | 39 (35) | 35 (33) | 38 (31) |
| II/ml total média de IgE (± DP) | 435 (754) | 432 (747) | 431 (776) |
| Células médias de contagem de eosinófilos do sangue da linha de base (± DP)/MCL | 350 (430) | 360 (370) | 350 (310) |
| ICS = corticosteróide inalado; FEV1 = Volume expiratório forçado em 1 segundo; AD = dermatite atópica; Np = pólipos nasais; AR = rinite alérgica; Feno = fração de óxido nítrico exalado |
Exacerbações em assuntos com asma
Dri12544 e Quest evaluated the frequency of severe asthma exacerbations defined as deterioration of asthma requiring the use of systemic corticosteroids for at least 3 days or hospitalization or emergency room visit due to asthma that required systemic corticosteroids. In the primary analysis population (subjects with baseline blood eosinophil count of ≥300 cells/mcL in DRI12544 e the overall population in BUSCA) subjects receiving either Dupixent 200 mg or 300 mg Q2W had significant reductions in the rate of asthma exacerbations compared to placebo. In the overall population in BUSCA the rate of severe exacerbations was 0.46 e 0.52 for Dupixent 200 mg Q2W e 300 mg Q2W respectively compared to matched placebo rates of 0.87 e 0.97. The rate ratio of severe exacerbations compared to placebo was 0.52 (95% CI: 0.41 0.66) e 0.54 (95% CI: 0.43 0.68) for Dupixent 200 mg Q2W e 300 mg Q2W respectively. Results in subjects with baseline blood eosinophil counts ≥300 cells/mcL in Dri12544 e Quest are shown in Table 21.
As taxas de resposta por eosinófilos sanguíneos basais e feno basal para missão são mostradas para a população geral na Figura 4 e Figura 5, respectivamente. A elevação do feno pode ser um marcador do fenótipo de asma eosinofílico quando suportado por dados clínicos. Análises de subgrupo pré-especificado de DRI12544 e Quest demonstraram que houve maiores reduções em exacerbações graves em indivíduos com níveis mais altos de eosinófilos sanguíneos da linha de base (≥150 células/MCL) ou FENO (≥25 ppb). Nas reduções de missões nas exacerbações, foram significativas no subgrupo de indivíduos com eosinófilos sanguíneos da linha de base ≥150 células/MCL. Em indivíduos com contagem inicial de eosinófilos de sangue <150 cells/mcL e FeNO <25 ppb similar severe exacerbation rates foram observados entre dupixent e placebo.
Na missão, a taxa de taxa estimada de exacerbações que leva a hospitalizações e/ou visitas de emergência em relação ao placebo foi de 0,53 (IC 95%: 0,28 1,03) e 0,74 (IC 95%: 0,32 1,70) com dupixent 200 mg ou 300 mg Q2W, respectivamente.
Tabela 21: Taxa de exacerbações graves em ensaios de asma (DRI12544 e missão)
| Julgamento | Tratamento | Blood Blood EOS> 300 células/MCL (Análise primária População DRI12544) | ||
| N | Parcelas (95% lá) | Razão de parcelas (IC 95%) | ||
| DRI12544 | Dupixent 200 mg Q2W | 65 | 0.30 (0,13 0,68) | 0.29 (0,11 0,76) |
| Dupixent 300 mg Q2W | 64 | 0.20 (0,08 0,52) | 0.19 (0,07 0,56) | |
| Placebo | 68 | 1.04 (0,57 1,90) | ||
| BUSCA | Dupixent 200 mg Q2W | 264 | 0.37 (0,29 0,48) | 0.34 (0,24 0,48) |
| Placebo | 148 | 1.08 (0,85 1,38) | ||
| Dupixent 300 mg Q2W | 277 | 0.40 (0,32 0,51) | 0.33 (0,23 0,45) | |
| Placebo | 142 | 1.24 (0,97 1,57) |
Figura 4: Risco relativo na taxa de eventos anualizada de exacerbações graves na contagem de eosinófilos sanguíneos da linha de base (células/MCL) em indivíduos com asma moderada a grave (missão)
 |
Figura 5: Risco relativo na taxa de eventos anualizada de exacerbações graves em todo o grupo FenO da linha de base (PPB) em indivíduos com asma moderada a grave (missão)
 |
O tempo para a primeira exacerbação foi mais longo para os sujeitos que receberam dupixent em comparação com o placebo na missão (Figura 6).
Figura 6: Curva de incidência de Kaplan Meier para o tempo para a primeira exacerbação grave em indivíduos com asma moderada a grave com eosinófilos de sangue basal ≥300 células/mcl (miss)a
 |
a No momento do bloqueio do banco de dados, nem todos os sujeitos haviam concluído a semana 52
Função pulmonar em assuntos com asma
Aumentos significativos no FEV pré-broncodilatador1 foram observados na semana 12 para o DRI12544 e a busca nas populações de análise primária (indivíduos com contagem inicial de eosinófilos sanguíneos de ≥300 células/MCL no DRI12544 e a população geral em busca). Na população geral em missão, o FEV1 A mudança média de LS da linha de base foi de 0,32 L (21%) e 0,34 L (23%) para dupixent 200 mg Q2W e 300 mg Q2W, respectivamente, em comparação com as médias placebo correspondentes de 0,18 L (12%) e 0,21 L (14%). A diferença média do tratamento versus placebo foi de 0,14 L (IC 95%: 0,08 0,19) e 0,13 L (IC 95%: 0,08 0,18) para dupixent 200 mg Q2W e 300 mg Q2W, respectivamente. Resultados em indivíduos com contagens de eosinófilos sanguíneos da linha de base ≥300 células/MCL no DRI12544 e missão são mostradas na Tabela 22.
Melhorias no FEV1 pelos eosinófilos sanguíneos da linha de base e feno basal para missão são mostrados nas Figura 7 e 8, respectivamente. A análise de subgrupos do DRI12544 e a missão demonstrou maior melhora em indivíduos com eosinófilos sanguíneos da linha de base mais altos (≥150 células/mcl) ou feno (≥25 ppb). Em indivíduos com contagem inicial de eosinófilos de sangue <150 cells/mcL e FeNO <25 ppb similar differences in FEV1 foram observados entre dupixent e placebo.
Mudanças médias no FEV1 Com o tempo em busca, são mostrados na Figura 9.
Tabela 22: Mudança média da linha de base e diferença vs placebo no pré-broncodilatador FEV1 na semana 12 em assuntos com asma moderada a severa (DRI12544 e missão)
| Julgamento | Tratamento | Blood Blood EOS ≥300 células/MCL (Análise primária População DRI12544) | ||
| N | LS significa mudança de linha de base L (%) | LS Diferença média vs. placebo (IC 95%) | ||
| DRI12544 | Dupixent 200 mg Q2W | 65 | 0.43 (25.9) | 0.26 (0,11 0,40) |
| Dupixent 300 mg Q2W | 64 | 0.39 (25,8) | 0.21 (0,06 0,36) | |
| Placebo | 68 | 0.18 (10.2) | ||
| BUSCA | Dupixent 200 mg Q2W | 264 | 0.43 (29.0) | 0.21 (0,13 0,29) |
| Placebo | 148 | 0.21 (15.6) | ||
| Dupixent 300 mg Q2W | 277 | 0.47 (32,5) | 0.24 (0,16 0,32) | |
| Placebo | 142 | 0.22 (14.4) |
Figura 7: LS Diferença média de mudança de linha de base versus placebo à semana 12 no FEV pré-broncodilatador1 nas contagens de eosinófilos sanguíneos da linha de base (células/mcl) em indivíduos com asma moderada a grave (missão)
| 1 across Baseline Blood Eosinophil Counts (cells/mcL) in Subjects with Moderate-to-Severe Asthma (QUEST) Illustration' src='//apotheke.buzz/img/interleukin-inhibitors/38/dupixent-6.webp' > |
Figura 8: LS Diferença média de mudança de linha de base versus placebo à semana 12 no pré -broncodilatador FEV1 Em todo o FenO da linha de base (PPB) em indivíduos com asma moderada- grave (missão)
| 1 across Baseline FeNO (ppb) in Subjects with Moderateto- Severe Asthma (QUEST) Illustration' src='//apotheke.buzz/img/interleukin-inhibitors/38/dupixent-7.webp' > |
Figura 9: Mudança média da linha de base no FEV pré-broncodilatador1 (L) Com o tempo em indivíduos com asma moderada a grave com eosinófilos de sangue basal ≥300 células/mcl (missão)
| 1 (L) Over Time in Subjects with Moderate-to-Severe Asthma with Baseline Blood Eosinophils =300 cells/mcL (QUEST) Illustration' src='//apotheke.buzz/img/interleukin-inhibitors/38/dupixent-8.webp' > |
Terminais secundários adicionais no estudo de asma (missão)
ACQ-5 e AQLQ (s) foram avaliados em busca às 52 semanas. A taxa de resposta foi definida como uma melhora na pontuação de 0,5 ou mais (intervalo de escala de 0-6 para ACQ-5 e 1-7 para AQLQ (s)).
- A taxa de resposta ACQ-5 para dupixent 200 mg e 300 mg de Q2W na população geral foi de 69% vs 62% placebo (odds ratio 1,37; IC 95%: 1,01 1,86) e 69% vs 63% placebo (Odds ratio 1,28; 95% IC: 0,94 1.7) respectivamente; e as taxas de resposta AQLQ (s) foram 62% vs 54% placebo (odds ratio 1,61; IC 95%: 1,17 2,21) e 62% vs 57% placebo (odds ratio 1,33; IC 95%: 0,98 1,81), respectivamente.
- A taxa de resposta ACQ-5 para dupixent 200 mg e 300 mg Q2W em indivíduos com eosinófilos sanguíneos basais ≥300 células/MCL foi de 75% vs 67% placebo (odds ratio: 1,46; IC 95%: 0,90 2,35) e 71% vs 64%; e as taxas de resposta AQLQ (s) foram 71% vs 55% placebo (odds ratio: 2,02; IC 95%: 1,24 3,32) e 65% vs 55% placebo (odds ratio: 1,79; IC 95%: 1,13 2,85), respectivamente.
Oual Corticosteroid Reduction In Asma Julgamento (RISCO)
RISCO evaluated the effect of Dupixent on reducing the use of maintenance oral corticosteroids. The baseline mean oral corticosteroid dose was 12 mg in the placebo group e 11 mg in the group receiving Dupixent. The primary endpoint was the percent reduction from baseline of the final oral corticosteroid dose at Week 24 while maintaining asthma control.
Comparado com os indivíduos com placebo que receberam dupixent obtiveram maiores reduções na dose diária de corticosteroides de manutenção diária, mantendo o controle da asma. A redução percentual média na dose diária de OCs da linha de base foi de 70% (mediana 100%) em indivíduos que receberam dupixent (IC 95%: 60% 80%) em comparação com 42% (mediana 50%) em indivíduos que receberam placebo (IC 95%: 33% 51%). Reduções de 50%ou mais na dose de OCS foram observadas em 82 (80%) indivíduos que receberam dupixent em comparação com 57 (53%) naqueles que recebem placebo. A proporção de indivíduos com uma dose final média inferior a 5 mg na semana 24 foi de 72% para dupixent e 37% para placebo (odds ratio 4,48 IC 95%: 2,39 8,39). Um total de 54 (52%) indivíduos que receberam dupixent versus 31 (29%) indivíduos no grupo placebo tiveram uma redução de 100%na dose de OCS.
In this 24-week trial asthma exacerbations (defined as a temporary increase in oral corticosteroid dose for at least 3 days) were lower in subjects receiving DUPIXENT compared with those receiving placebo (annualized rate 0.65 and 1.60 for the DUPIXENT and placebo group respectively; rate ratio 0.41 [95% CI 0.26 0.63]) and improvement in pre-bronchodilator FEV1 Da linha de base à semana 24 foi maior em indivíduos que receberam dupixent em comparação com aqueles que recebem placebo (LS média diferença para dupixent versus placebo de 0,22 L [IC 95%: 0,09 a 0,34 L]). Os efeitos na função pulmonar e na redução de esteróides e exacerbação orais foram semelhantes, independentemente dos níveis basais de eosinófilos sanguíneos. O ACQ-5 e o AQLQ (s) também foram avaliados em empreendimento e mostraram melhorias semelhantes às da busca.
Indivíduos pediátricos de 6 a 11 anos de idade com asma
A eficácia e a segurança do dupixent em indivíduos pediátricos foram avaliados em um estudo clínico de 52 semanas, clínico-de-dublagem, controlado por placebo (Voyage; NCT02948959) em 408 indivíduos 6 a 11 anos de idade com uma asma de controles moderada a ou de um dose-altos e altos e altos. Os indivíduos foram obrigados a ter um histórico de 1 ou mais exacerbação (s) de asma, que exigia tratamento com corticosteróides sistêmicos ou visita ou hospitalização do departamento de emergência para o tratamento da asma no ano anterior à entrada do julgamento. Os indivíduos foram randomizados para dupixent (n = 273) ou placebo correspondente (n = 135) a cada 2 semanas com base no peso corporal <30 kg (100 mg Q2W) or ≥30 kg (200 mg Q2W). The effectiveness of Dupixent 300 mg Q4W was extrapolated from efficacy of 100 mg Q2W in VIAGEM with support from population pharmacokinetic analyses showing higher drug exposure levels with 300 mg Q4W [see Uso pediátrico e Farmacocinética ].
O endpoint primário foi a taxa anualizada de eventos graves de exacerbação de asma durante o período controlado por placebo de 52 semanas. As exacerbações graves da asma foram definidas como deterioração da asma, exigindo o uso de corticosteróides sistêmicos por pelo menos 3 dias ou visita de hospitalização ou emergência devido à asma que exigia corticosteróides sistêmicos. O ponto final secundário principal foi a mudança da linha de base no FEV pré-broncodilatador1 A porcentagem prevista na semana 12. De extremidade secundária adicionais incluíram alterações médias das taxas de linha de base e resposta no ACQ-7-IA (Questionário de Controle de Astma-7-7-Interviewer administrado) e PAQLQ (S) -IA (Pediatric Astric Quality of Life Questionnaire com atividades padronizadas administradas).
As características demográficas e de linha de base para a viagem são fornecidas na Tabela 23 abaixo.
Tabela 23: Demografia e características basais dos sujeitos pediátricos de 6 a 11 anos de idade com asma (viagem)
| Parâmetro | VIAGEM (N = 408) |
| Idade média (anos) (DP) | 9 (2) |
| % Fêmea | 36 |
| % Branco | 88 |
| Peso corporal médio (kg) | 36 |
| Exacerbações médias no ano anterior (± DP) | 2.4 (2.2) |
| Uso de ICs de alta dose (%) | 44 |
| FEV pré-dose1 (L) na linha de base (± DP) | 1.48 (0,41) |
| Porcentagem média de FEV previsto1 (%) (± DP) | 78 (15) |
| % De reversibilidade média (± DP) | 20 (21) |
| História médica atópica % geral | 92 |
| (Ad % ar %) | (36 82) |
| FenO ppb médio (± DP) | 28 (24) |
| % subjects with FeNO ppb >20 | 50 |
| Mediana Total IGE IU/ML (± DP) | 792 (1093) |
| Células médias de contagem de eosinófilos da linha de base (± DP)/MCL | 502 (395) |
| ICS = corticosteróide inalado; FEV1 = Volume expiratório forçado em 1 segundo; AD = dermatite atópica; AR = rinite alérgica; Feno = fração de óxido nítrico exalado |
Dupixent significantly reduced the annualized rate of severe asthma exacerbation events during the 52-week treatment period compared to placebo in populations with an eosinophilic phenotype as indicated by elevated blood eosinophils e/or the population with elevated FeNO. Subgroup analyses for results of Dupixent treatment based upon either baseline eosinophil level or baseline FeNO level were similar to the pediatric (12 to 17 years of age) e adult trials e are described for the adult e pediatric (12 to 17 years of age) asthma population above. In subjects with baseline blood eosinophil count <150 cells/mcL e FeNO <20 ppb similar severe asthma exacerbation rates foram observados entre dupixent e placebo.
Melhorias significativas na porcentagem previamente previu FEV pré-broncodilatador1 foram observados na semana 12. Melhorias significativas na porcentagem previam FEV1 foram observados no início da semana 2 e mantidos até a semana 52 em viagem (Figura 10).
Os resultados da eficácia para viagem são apresentados na Tabela 24.
Tabela 24: Resultados da eficácia do dupixent em indivíduos pediátricos 6 a 11 anos de idade com asma (viagem)
| Tratamento | EOS ≥300 células/MCLa | ||
| As exacerbações graves anualizadas têm uma taxa de mais de 52 semanas | |||
| N | Parcelas (95% lá) | Razão de parcelas (IC 95%) | |
| Dupixent 100 mg Q2Wb (<30 kg)/ 200 mg Q2W (≥30 kg) | 175 | 0.24 (0,16 0,35) | 0.35 (0,22 0,56) |
| Placebo | 84 | 0.67 (0,47 0,95) | |
| Mudança média em relação à linha de base em porcentagem prevista FEV1 na semana 12 | |||
| N | LS significa A da linha de base | LS Diferença média vs. placebo (IC 95%) | |
| Dupixent 100 mg Q2Wb (<30 kg)/ 200 mg Q2W (≥30 kg) | 168 | 10.15 | 5.32 (1,76 8,88) |
| Placebo | 80 | 4.83 | |
| a Isso reflete a população de análise primária pré -especificada para viagem nos Estados Unidos. b A eficácia do dupixent 300 mg Q4W foi extrapolada da eficácia de 100 mg Q2W. |
Figura 10: Mudança média da linha de base em porcentagem prevista pré-broncodilatador FEV1 (L) Com o tempo em indivíduos pediátricos 6 a 11 anos de idade em viagem (eosinófilos de sangue basal ≥300 células/MCL)
| 1 (L) Over Time in Pediatric Subjects 6 to 11 Years of Age in VOYAGE (Baseline Blood Eosinophils =300 cells/mcL) Illustration' src='//apotheke.buzz/img/interleukin-inhibitors/38/dupixent-9.webp' > |
Também foram observadas melhorias para o ACQ-7-IA e PAQLQ (s) -IA na semana 24 e foram sustentadas na semana 52. Maiores taxas de resposta foram observadas para ACQ-7-IA e PAQLQ (s) -Ia em comparação com PACEBO na semana 24. A taxa de resposta foi definida como uma melhoria e a pontuação de 0,5 ou mais (escala de 0-6 para 24 para o ACQ-7-7-7-7. In the subgroup of subjects with baseline blood eosinophil count ≥300 cells/mcL DUPIXENT led to a higher proportion of subjects with a response in ACQ-7-IA (80.6% versus 64.3% for placebo) with an OR of 2.79 (95% CI: 1.43 5.44) and in PAQLQ(S)-IA (72.8% versus 63.0% for placebo) with an OR of 1.84 (IC 95%: 0,92 3,65) na semana 24.
Rinossinusite crônica com pólipos nasais
The efficacy of DUPIXENT as an add-on maintenance treatment in adults with inadequately controlled chronic rhinosinusitis with nasal polyps (CRSwNP) was evaluated in two randomized double-blind parallel-group multicenter placebo-controlled studies (SINUS-24 (NCT02912468) and SINUS-52 (NCT02898454)) in 724 adult subjects 18 anos de idade ou mais no fundo corticosteróides intranasais (incs). Esses estudos incluíram indivíduos com CRWNP, apesar da cirurgia sino-nasal anterior ou tratamento com ou que não eram elegíveis para receber ou foram intolerantes a corticosteróides sistêmicos nos últimos 2 anos. Indivíduos com rinossinusite crônica sem pólipos nasais não foram incluídos nesses ensaios. Foi permitido resgate com corticosteróides sistêmicos ou cirurgia durante os estudos a critério do investigador. No seio-24, um total de 276 indivíduos foi randomizado para receber 300 mg de dupixent (n = 143) ou placebo (n = 133) a cada 2 semanas por 24 semanas. No seio 52, 448 indivíduos foram randomizados para receber 300 mg de dupixent (n = 150) a cada 2 semanas por 52 semanas 300 mg dupixent (n = 145) a cada 2 semanas até a semana 24, seguidos por 300 mg dupixent a cada 4 semanas até a semana 52 ou placebo (n = 153). Todos os indivíduos tinham evidências de opacificação sinusal na tomografia computadorizada de Lund Mackay (LMK) e 73% a 90% dos indivíduos tiveram opacificação de todos os seios. Os indivíduos foram estratificados com base em suas histórias de cirurgia prévia e asma-mórbido/anti-inflamatória não-inflamatória exacerbada por doença respiratória (ANS-ERD). Um total de 63% dos indivíduos relataram cirurgia sinusal anterior com um número médio de 2,0 cirurgias anteriores, 74% usaram corticosteróides sistêmicos nos 2 anos anteriores, com um número médio de 1,6 cursos de corticosteróides sistêmicos nos 2 anos anteriores, 59% apresentavam asma-mórbida e 28% tinham NSAID-ERD.
Os endpoints de eficácia da co-primária foram alterações da linha de base para a semana 24 na pontuação bilateral de pólipos nasais endoscópicos (NPS; escala de 0 a 8), conforme graduado pelos leitores cegos centrais e a mudança da linha de base para a semana 24 na escala de congestionamento/obtualização nasal, em média, em 28 dias (NC; 0-3), como determinado por subfinios usando os subfinios por meio de um diariamente de um diarifuso. Para os pólipos NPs em cada lado do nariz, foram classificados em uma escala categórica (0 = sem pólipos; 1 = pequenos pólipos no meato médio que não atingem abaixo da borda inferior do turbinato médio; 2 = pólipos que atingem a borda inferior da borda inferior do turbinato médio; 3 = Polipos grandes da borda inferior do polim inferior; cavidade nasal inferior). A pontuação total foi a soma das pontuações direita e esquerda. A congestão nasal foi classificada diariamente pelos sujeitos em uma escala de gravidade categórica de 0 a 3 (0 = sem sintomas; 1 = sintomas leves; 2 = sintomas moderados; 3 = sintomas graves).
Em ambos os estudos, os principais pontos finais secundários na semana 24 incluíram a mudança da linha de base em: LMK Sinus CT Scão Scon Scon Score Dernta de cheiro diário e teste de resultado sino-nasal de 22 itens (SNOT-22). O escore de tomografia computadorizada do seio LMK avaliou a opacificação de cada seio usando uma escala de 0 a 2 (0 = normal; 1 = opacificação parcial; 2 = opacificação total), derivando uma pontuação máxima de 12 por lado e uma pontuação máxima total de 24 (pontuações mais altas indicam mais opacificação). A perda de cheiro foi pontuada refletivamente pelo sujeito todas as manhãs em uma escala de 0-3 (0 = sem sintomas 1 = sintomas leves 2 = sintomas moderados 3 = sintomas graves). O SNOT-22 inclui 22 itens que avaliam os sintomas e o impacto dos sintomas associados ao CRWNP, com cada item pontuado de 0 (sem problemas) a 5 (o problema o mais ruim possível) com uma pontuação global que varia de 0 a 110. O SNOT-22 teve um período de recall de 2 semanas. Nos resultados da eficácia combinada, foram avaliadas a redução da proporção de indivíduos resgatados com corticosteróides sistêmicos e/ou cirurgia sino-nasal (até a semana 52).
As características demográficas e basais desses 2 ensaios são fornecidas na Tabela 25 abaixo.
Tabela 25: Demografia e características de linha de base de indivíduos adultos em ensaios de CRSWNP
| Parâmetro | Sinusão-24 (N = 276) | Sino-52 (N = 448) |
| Idade média (anos) (DP) | 50 (13) | 52 (12) |
| % Macho | 57 | 62 |
| Duração média do CRSWNP (anos) (DP) | 11 (9) | 11 (10) |
| Indivíduos com ≥1 cirurgia anterior (%) | 72 | 58 |
| Indivíduos com uso sistêmico de corticosteróide nos 2 anos anteriores (%) | 65 | 80 |
| NPS endoscópicos bilaterais médiosa (SD) Faixa 0-8 | 5.8 (1.3) | 6.1 (1.2) |
| Pontuação média de congestionamento nasal (NC)a (SD) Faixa 0-3 | 2.4 (0,6) | 2.4 (0,6) |
| Pontuação total do Sinus CT Sinus médioa (SD) Faixa 0-24 | 19 (4.4) | 18 (3.8) |
| Pontuação média de perda de cheiroa (AM) (DP) Faixa 0-3 | 2,7 (0,5) | 2,8 (0,5) |
| Pontuação total do NOT-22a (SD) Faixa 0-110 | 49.4 (20.2) | 51,9 (20,9) |
| Eosinófilos médios do sangue (células/MCL) (DP) | 440 (330) | 430 (350) |
| II/ml total médio de IGE (SD) | 212 (276) | 240 (342) |
| História médica atópica % geral | 75 | 82 |
| Asma (%) | 58 | 60 |
| AINE-ERD (%) | 30 | 27 |
| a Pontuações mais altas indicam maior gravidade da doença SD = desvio padrão; AM = manhã; NPS = pontuação de pólipos nasais; SNOT-22 = teste de resultado sino-nasal de 22 itens; AINE-ERD = asma/anti-inflamatória não esteróidal exacerbado por doença respiratória |
Resposta clínica (Sinus-24 e Sinus-52)
Os resultados para pontos finais primários nos estudos de CRSWNP são apresentados na Tabela 26.
Tabela 26: Resultados dos pontos finais primários em ensaios de CRSWNP
| Sinusão-24 | Sino-52 | |||||||||
| Placebo (n = 133) | Dupixent 300 mg Q2W (n = 143) | LS Diferença média vs. placebo (IC 95%) | Placebo (n = 153) | Dupixent 300 mg Q2W (n = 295) | LS Diferença média vs. placebo (IC 95%) | |||||
| Terminais primários na semana 24 | ||||||||||
| Pontuações | Média da linha de base | LS significa mudança | Média da linha de base | LS significa mudança | Média da linha de base | LS significa mudança | Média da linha de base | LS significa mudança | ||
| NPS | 5.86 | 0.17 | 5.64 | -1.89 | -2.06 (-2,43 -1.69) | 5.96 | 0.10 | 6.18 | -1.71 | -1.80 (-2,10 -1,51) |
| NC | 2.45 | -0.45 | 2.26 | -1.34 | -0.89 (-1,07 -0,71) | 2.38 | -0.38 | 2.46 | -1.25 | -0.87 (-1,03 -0,71) |
| Uma redução na pontuação indica melhora. NPS = nasal polyps score; NC = nasal congestion/obstruction |
A eficácia estatisticamente significativa foi observada no seio 52 em relação à melhora no escore endoscópico bilateral de NPs na semana 24 e na semana 52 (ver Figura 11).
Figura 11: LS Média média da linha de base na pontuação bilateral dos pólipos nasais (NPs) até a semana 52 em indivíduos com 18 anos de idade e mais com o CRSWNP (Sinus -52 - ITT Population)
 |
Resultados semelhantes foram observados no seio-24 na semana 24. No período pós-tratamento, quando os indivíduos estavam fora do dupixent, o efeito do tratamento diminuiu ao longo do tempo (veja a Figura 12).
Figura 12: A mudança média de LS da linha de base na pontuação bilateral dos pólipos nasais (NPs) até a semana 48 em indivíduos com 18 anos de idade ou mais com o CRSWNP (Sinus -24 - ITT Population)
 |
Na semana 52, a diferença média do LS para congestão nasal no grupo dupixent versus placebo foi de -0,98 (IC 95% -1,17 -0,79). Em ambos os estudos, melhorias significativas no congestionamento nasal foram observadas desde a primeira avaliação na semana 4. A diferença média do LS para o congestionamento nasal na semana 4 no grupo dupixent versus placebo foi de -0,41 (IC 95%: -0,52 -0,30) em sinus -24 e -0.37 (95% aC: -0: -0.
Foi observada uma diminuição significativa no escore de tomografia computadorizada do seio LMK. A diferença média do LS para a pontuação da tomografia computadorizada do seio LMK na semana 24 no grupo dupixent versus placebo foi de -7,44 (IC 95%: -8,35 -6,53) no seio -24 e -5,13 (IC 95%: -5,80 -4,46) no seio -52. Na semana 52, no seio -52, a diferença média do LS para a pontuação da tomografia computadorizada do seio LMK no grupo dupixent versus placebo foi de -6,94 (IC 95%: -7,87 -6,01).
O dupilumab melhorou significativamente a perda de cheiro em comparação com o placebo. A diferença média do LS para perda de cheiro na semana 24 no grupo dupixent versus placebo foi de -1,12 (IC 95%: -1,31 -0,93) no seio -24 e -0,98 (IC 95%: -1,15 -0,81) no seio -52. Na semana 52, a diferença média do LS para perda de cheiro no grupo dupixent versus placebo foi de -1,10 (IC 95% -1,31 -0,89). Em ambos os estudos, melhorias significativas na perda diária de gravidade do cheiro foram observadas desde a primeira avaliação na semana 4.
O dupilumab diminuiu significativamente os sintomas sino-nasais, medidos pelo SNOT-22 em comparação com o placebo. A diferença média do LS para o SNOT -22 na semana 24 no grupo dupixent versus placebo foi de -21,12 (IC 95%: -25,17 -17,06) no seio -24 e -17,36 (IC 95%: -20,87 -13,85) no seio -52. Na semana 52, a diferença média do LS no grupo dupixent versus placebo foi de -20,96 (IC 95% -25,03 -16,89).
Tiro mais fino de sangue no estômago
Na análise combinada com multiplicidade pré-especificada de dois estudos, o tratamento com dupixent resultou em redução significativa do uso sistêmico de corticosteróide e necessidade de cirurgia sino-nasal versus placebo (HR de 0,24; IC 95%: 0,17 0,35) (ver Figura 13). A proporção de indivíduos que exigiram corticosteróides sistêmicos foi reduzida em 74% (FC de 0,26; IC 95%: 0,18 0,38). O número total de cursos de corticosteróide sistêmico por ano foi reduzido em 75% (RR de 0,25; IC 95%: 0,17 0,37). A proporção de indivíduos que exigiram a cirurgia foi reduzida em 83% (FC de 0,17; IC 95%: 0,07 0,46).
Figura 13: Curva de Kaplan Meier por tempo ao primeiro uso sistêmico de corticosteróides e/ou cirurgia sino-nasal durante o período de tratamento em indivíduos com 18 anos de idade e mais com o CRSWNP (Sinus-24 e Sinus-52.
 |
Os efeitos do dupixent nos pontos finais primários do NPS e congestionamento nasal e o principal ponto final secundário do escore de tomografia computadorizada do seio LMK foram consistentes em indivíduos com cirurgia prévia e sem cirurgia prévia.
Em indivíduos com melhorias de asma com córbido no FEV pré-broncodilatador1 eram semelhantes aos sujeitos no programa de asma.
Esofagite eosinofílica
Indivíduos adultos e pediátricos com 12 anos de idade ou mais com EOE
Um único estudo randomizado duplo-cego de grupo paralelo paralelo controlado por placebo, incluindo dois períodos de tratamento de 24 semanas (o estudo EOE-1 Partes A e B) foi realizado em indivíduos adultos e pediátricos com 12 anos de idade e mais com pesagem de pelo menos 40 kg com EOE (NCT03633617). Em ambas as partes, os indivíduos foram randomizados para receber 300 mg de dupixent toda semana ou placebo. Os indivíduos elegíveis tinham ≥15 eosinófilos intraepiteliais por campo de alta potência (EOS/HPF) após um curso de tratamento de um inibidor da bomba de prótons (PPI) antes ou durante o período de triagem e sintomas da disfagia, conforme medido pelo questionário de sintoma da disfagia (DSQ). Na linha de base, 43% dos indivíduos na Parte A e 37% dos indivíduos na Parte B tinham histórico de dilatações anteriores do esôfago.
Demographics and baseline characteristics were similar in Parts A and B. A total of 81 subjects (61 adults and 20 pediatric subjects) were enrolled in Part A and 159 subjects (107 adults and 52 pediatric subjects) were enrolled in Part B. The mean age in years was 32 years (range 13 to 62 years) in Part A and 28 years (range 12 to 66 years) in Part B. The majority of subjects were male (60% in Part A e 68% na Parte B) e branco (96% na Parte A e 90% na Parte B). A pontuação média do DSQ da linha de base (DP) foi de 33,6 (12,4) na parte A e 37.2 (10.7) na Parte B.
Os endpoints de eficácia coprimária nas partes A e B foram a (1) proporção de indivíduos que atingiam a remissão histológica definida como pico de contagem de eosinófilos intraepiteliais esopiteliais de ≤6 EOS/HPF na semana 24; e (2) a mudança absoluta na pontuação DSQ relatada pelo sujeito da linha de base para a semana 24.
Os resultados da eficácia das partes A e B são apresentados na Tabela 27.
Tabela 27: Resultados da eficácia do dupixent na semana 24 em indivíduos adultos e pediátricos com 12 anos de idade ou mais com EOE (estudo EOE-1 Partes A e B)
| Estude Eoe-1 Parte A | Estude EoE-1 Parte B | |||||
| Dupixent 300 mg QWb N = 42 | Placebob N = 39 | Diferença vs. placebo (IC 95%)b | Dupixent 300 mg QWb N = 80 | Placebob N = 79 | Diferença vs. placebo (IC 95%)b | |
| Terminais co-primários | ||||||
| Proporção de indivíduos que atingem a remissão histológica (pico de contagem de eosinófilos intraepiteliais do esopitelial ≤6 eos/hpf) n (%) | 25 (59,5) | 2 (5.1) | 57 0 (40,9 73.1) | 47 (58,8) | 5 (6.3) | 53 5 (41.2 65.8) |
| Mudança absoluta da linha de base na pontuação do DSQ (0-84a) LS média (SE) | -21,9 (2.5) | -9,6 (2.8) | -12.3 (-19.1 -5,5) | -23,8 (1,9) | -13,9 (1,9) | -9.9 (-14,8 -5,0) |
| a Os escores totais de DSQ total variam de 0 a 84; Pontuações mais altas indicam maior frequência e gravidade da disfagia b Para remissão histológica, a diferença nas porcentagens é estimada usando o método Cochran Mantel Henszel ajustando os fatores de estratificação de randomização. Para alteração absoluta na pontuação do DSQ, as alterações médias de LS são estimadas por meio de alterações e diferenças padrão usando um modelo ANCOVA com fatores de estratificação de randomização do grupo de tratamento e medição da linha de base como covariáveis. |
Nas partes A e B, uma proporção maior de indivíduos randomizados a Dupixent alcançou a remissão histológica (pico de contagem de eosinófilos intraepiteliais esofágicos ≤6 eos/hpf) em comparação com o placebo. O tratamento com dupixent também resultou em uma melhora significativa na alteração média de LS na pontuação do DSQ em comparação com o placebo na semana 24. Os resultados das análises baseadas em âncora que incorporaram os sujeitos '
Indivíduos pediátricos 1 a 11 anos de idade pesando pelo menos 15 kg com EoE
A eficácia e a segurança do dupixent foram avaliadas em indivíduos pediátricos de 1 a 11 anos de idade, pesando pelo menos 15 kg com EOE em um estudo multicêntrico de grupo paralelo randomizado (estudo EOE-2 A e B; NCT04394351). Os indivíduos elegíveis tinham ≥15 eosinófilos intraepiteliais por campo de alta potência (EOS/HPF), apesar de um curso de tratamento de um inibidor da bomba de prótons (PPI) antes ou durante o período de triagem e um histórico de sinais e sintomas de EOE. Parte A avaliada por regimes de dosagem baseados em peso de dupixent 200 mg Q2W (≥15 a <30 kg) e 300 mg Q2W (≥30 to <60 kg) or placebo in 61 subjects during the 16-week treatment period.
A dose recomendada de 300 mg de qw para indivíduos pediátricos 1 a 11 anos de pesagem ≥40 kg é baseada em dados farmacocinéticos modelados para fornecer exposições comparáveis à dosagem de 300 mg de QW em adultos e pediatria de 12 anos de idade e pesar ≥40 kg com eoe [consulte a eoe Dosagem e administração e Farmacocinética ].
Quarenta e sete indivíduos que concluíram a Parte A foram avaliados no período de tratamento ativo estendido de 36 semanas (estudo EOE-2 Parte B). Todos os sujeitos da Parte B foram tratados com os regimes de dosagem baseados em peso de dupixent descritos para a Parte A.
Do total de indivíduos avaliados na parte A, a idade média foi de 8 anos, o peso médio foi de 28 kg e 75% eram do sexo masculino. Sete por cento identificados como hispânicos ou latinos; 85% identificados como brancos 12% como pretos 2% como asiáticos e 2% identificados como outro subgrupo racial.
O endpoint primário de eficácia na Parte A foi a proporção de indivíduos que atingiam a remissão histológica definida como pico da contagem de eosinófilos intraepiteliais de esofágica de ≤6 EOS/HPF na semana 16.
Os resultados da eficácia da Parte A são apresentados na Tabela 28.
Tabela 28: Resultados da eficácia do dupixent na semana 16 nos sujeitos 1 a 11 anos de idade, com Eoe pesando pelo menos 15 kg (estudo EOE-2 Parte A)
| Dupixenta N = 32 | Placebo N = 29 | Diferença vs placebo (IC 95%) | |
| Proporção de indivíduos que atingem a remissão histológica (pico de contagem de eosinófilos intraepiteliais do esopitelial ≤6 eos/hpf) n (%)b | 21 (65,6) | 1 (3.4) | 62.0 (44,00 79,95) |
| a Dupixent was evaluated at tiered dosing regimens based on body weight: ≥15 to <30 kg (200 mg Q2W) e ≥30 to <60 kg (300 mg Q2W). The 300 mg Q2W dosing regimen is lower than the recommended dosage of Dupixent in subjects ≥40 kg [see Dosagem e administração ]. b A diferença nas porcentagens é estimada usando o método Mantel-Haenszel ajustando para o grupo de peso da linha de base (≥15 para<30 kg e ≥30 to <60 kg). |
Na Parte B, a remissão histológica foi alcançada na semana 52 em 17/32 indivíduos tratados com dupixent nas partes A e B e 8/15 indivíduos tratados com placebo na Parte A e Dupixent na Parte B.
No estudo EOE-2 Parte A Um resultado relatado pelo observador O Centro de Questionário de Sign/Sintoma Pediátrico (PESQ-C) foi usado para medir sinais de EOE. Foi observada uma maior diminuição na proporção de dias com 1 ou mais sinais de EOE (com base no PESQ-C) para indivíduos tratados com dupixent em comparação com placebo após 16 semanas de tratamento.
Prurigo nodularis
The prurigo nodularis (PN) development program included two 24-week randomized doubleblind placebo-controlled multicenter parallel-group trials (PRIME (NCT04183335) and PRIME 2 (NCT04202679)) in 311 adult subjects 18 years of age and older with pruritus (WINRS ≥ 7 on a scale of 0 to 10) and greater than or equal to 20 nodular lesions. O Prime e o Prime 2 avaliaram o efeito do dupixent na melhoria do prurido, bem como seu efeito nas lesões de PN.
Nesses dois ensaios, os indivíduos receberam dupixent 600 mg subcutâneos (duas injeções de 300 mg) no dia 1, seguidas de 300 mg uma vez a cada 2 semanas (Q2W) por 24 semanas ou placebo correspondente.
Nesses ensaios, a idade média foi de 49,5 anos, o peso médio era de 71 kg 65% dos indivíduos eram do sexo feminino que 57% eram brancos 6% eram pretos e 34% eram asiáticos. Na linha de base, a pior escala de classificação de coceira numérica (Wi-NRS) foi de 8,5 66% tinha 20 a 100 nódulos (moderados) e 34% tinham maiores que 100 nódulos (graves). Onze por cento (11%) dos indivíduos estavam tomando doses estáveis de antidepressivos na linha de base e foram instruídos a continuar tomando esses medicamentos durante o estudo. Quarenta e três por cento (43%) tinham um histórico de atropia (definido como tendo histórico médico de rinite alérgica/rinoconjuntivite asma ou alergia alimentar).
O Wi-NRS é composto por um único item classificado em uma escala de 0 (sem coceira) a 10 (pior coceira imaginável). Os indivíduos foram solicitados a classificar a intensidade de seu pior prurido (coceira) nas últimas 24 horas usando essa escala. A avaliação global do investigador para o Stayis Purigo Nodularis (IGA PN-S) é uma escala que mede o número aproximado de nódulos usando uma escala de 5 pontos de 0 (transparente) a 4 (grave).
A eficácia foi avaliada com a proporção de indivíduos com melhora (redução) em Wi-NRs em ≥4 pontos a proporção de indivíduos com IgA Pn-S 0 ou 1 (o equivalente a 0-5 nódulos) e a proporção de critérios que atingiram uma resposta no Wi-NRS e IGA-PN-S por critérios descritos acima.
Os resultados da eficácia para Prime e Prime2 são apresentados na Tabela 29 e nas Figuras 14 15 e 16.
Tabela 29: Resultados de eficácia de dupixent em indivíduos adultos com PN no Prime e Prime2
| MELHOR | MELHOR2 | |||||
| Placebo (N = 76) | Dupixent 300 mg Q2W (N = 75) | Diferença (IC 95%) para dupixent vs. placebo | Placebo (N = 82) | Dupixent 300 mg Q2W (N = 78) | Diferença (IC 95%) para dupixent vs. placebo | |
| Proporção de indivíduos com uma melhoria (redução) no Wi-NRS em ≥4 pontos da linha de base para a semana 24 e um IGA PN-S 0 ou 1 na semana 24b | 9,2% | 38,7% | 29,6% (16,4 42,8) | 8,5% | 32,1% | 25,5% (13,1 37,9) |
| Proporção de indivíduos com melhora (redução) em Wi-NRs em ≥4 pontos da linha de base na semana 24b | 18,4% | 60,0% | 42,7% (27,8 57,7) | 19,5% | 57,7% | 42,6% (29,1 56.1) |
| Proporção de indivíduos com IGA PN-S 0 ou 1 na semana 24b | 18,4% | 48,0% | 28,3% (13,4 43,2) | 15,9% | 44,9% | 30,8% (16,4 45.2) |
| Proporção de indivíduos com melhora (redução) no Wi-NRS em ≥4 pontos da linha de base na semana 12b | 15,8%a | 44,0%a | 29,2% (14,5 43,8)a | 22,0% | 37,2% | 16,8% (2,3 31,2) |
| a Não ajustado para multiplicidade no prime. b Os indivíduos que receberam tratamento de resgate anteriormente ou tiveram dados ausentes foram considerados como não respondentes. |
Figura 14: Proporção de indivíduos adultos com PN com Wi-NRS ≥4 pontos de melhoria e IgA pn-s 0 ou 1 ao longo do tempo no Prime e Prime2
 |
Figura 15: Proporção de indivíduos adultos com PN com Wi-NRS ≥4 pontos de 4 pontos ao longo do tempo no Prime e Prime2
 |
Figura 16: Proporção de indivíduos adultos com IGA PN-S 0 ou 1 ao longo do tempo no Prime e Prime 2
 |
Os dados de eficácia não mostraram efeito de tratamento diferencial entre os subgrupos demográficos.
Doença pulmonar obstrutiva crônica
The efficacy of DUPIXENT as add-on maintenance treatment of adult patients with inadequately controlled COPD and an eosinophilic phenotype was evaluated in two randomized double-blind multicenter parallel-group placebo-controlled trials (BOREAS [NCT03930732] and NOTUS [NCT04456673]) of 52 weeks duration. Os dois ensaios inscreveram um total de 1874 indivíduos adultos com DPOC.
Ambos os ensaios inscreveram indivíduos com um diagnóstico de DPOC com limitação de fluxo de ar moderado a grave (pós-broncodilatador FEV1Razão /FVC <0.7 e post-bronchodilator FEV1 de 30% a 70% previstos) e uma contagem mínima de eosinófilos sanguíneos de 300 células/MCL na triagem. A inscrição no estudo exigiu um histórico de exacerbação de pelo menos 2 exacerbação moderada ou 1 grave no ano anterior, apesar de receber terapia tripla de manutenção, consistindo em um antagonista muscarínico de ação prolongado (LAMA) a agonista beta (LABA) e inalou o pastosteróides do menos. Maiores ou iguais a 95% dos indivíduos em cada estudo tiveram bronquite crônica. Os indivíduos também tiveram uma pontuação do Conselho de Pesquisa Médica (MRC) ≥2 (intervalo 0-4). As exacerbações da DPOC foram definidas como agravamento clinicamente significativo dos sintomas da DPOC, incluindo aumentos no volume de escarro da tosse de dispnéia e/ou aumento da purulência do escarro. A gravidade da exacerbação foi definida posteriormente como moderada se o tratamento com corticosteróides sistêmicos e/ou antibióticos fosse necessário ou grave se resultaram em hospitalização ou observação por mais de 24 horas em um departamento de emergência ou em um centro de atendimento urgente.
Nos dois ensaios, os indivíduos foram randomizados para receber dupixent 300 mg por subcutânea a cada 2 semanas (Q2W) ou placebo, além de sua terapia de manutenção em segundo plano por 52 semanas.
As características demográficas e basais das populações de teste de Boreas e Notus são fornecidas na Tabela 30 abaixo.
Tabela 30: Demografia e características de base de indivíduos adultos com DPOC para populações de teste Boreas e Notus
| Parâmetro | Norte (N = 939) | Conhecido (N = 935) |
| Idade média (anos) (± DP) | 65.1 (8.1) | 65,0 (8.3) |
| Macho (%) | 66.0 | 67.6 |
| Branco n (%) | 790 (84.1) | 838 (89,6) |
| N (%) asiático (%) | 134 (14.3) | 10 (1.1) |
| Preto n (%) | 5 (0,5) | 12 (1.3) |
| Índia americano ou nativo do Alasca (%) | 7 (0,7) | 48 (5.1) |
| Outro/múltiplo n (%) | 3 (0,3) | 27 (2,9) |
| Etnia hispânica/latina n (%) | 261 (27,8) | 300 (32.1) |
| História média do tabagismo (ano-ano) (± DP) | 40,5 (23.4) | 40.3 (27.2) |
| Fumantes atuais (%) | 30.0 | 29.5 |
| Bronquite crônica (%) | 95.0 | 99.9 |
| Enfisema (%) | 32.6 | 30.4 |
| Número médio de moderadoa ou graveb exacerbações no ano anterior (± DP) | 2.3 (1.0) | 2.1 (0,9) |
| Antecedentes da DPOC Medications at Randomization: ICS/LAMA/LABA (%) | 97.6 | 98.8 |
| Pós-broncodilatador médio FEV1Razão /FVC (± SD) | 0,49 (0,12) | 0,50 (0,12) |
| Pós-broncodilatador médio FEVi (L) (± SD) | 1,40 (0,47) | 1,45 (0,49) |
| Percentual média prevista pós-broncodilatador FEV1(%) (± DP) | 50.6 (13.1) | 50.1 (12.6) |
| Pontuação total média do SGRQ (± DP) | 48.4 (17.4) | 51,5 (17.0) |
| Triagem média do sangue eosinófilos (células/mcl) (± DP) | 521 (307) | 538 (333) |
| Blood Blood Eosinophil Countd (células/MCL) (± DP) | 401 (298) | 407 (336) |
| ICS = corticosteróide inalado; Lama = antagonista muscarínico de ação prolongada; LABA = agonista beta de ação prolongada; FEV1 = volume expiratório forçado em 1 segundo; FVC = capacidade vital forçada a Exacerbações tratadas com corticosteróides sistêmicos e/ou antibióticos. b Exacerbações que requerem hospitalização ou observação por mais de 24 horas em um departamento de emergência ou instalação de atendimento urgente. c Triagem relatada O valor eosinófilo são os valores mais altos de até três testes d O valor da linha de base relatado foi obtido no valor de 4 semanas após o valor da triagem |
Exacerbações em indivíduos adultos com DPOC
O objetivo principal dos ensaios de Boreas e Notus foi a taxa anualizada de exacerbações moderadas ou graves da DPOC durante o período de tratamento de 52 semanas. Nos dois ensaios, o Dupixent demonstrou uma redução significativa na taxa anualizada de exacerbações moderadas ou graves da DPOC em comparação ao placebo quando adicionado à terapia de manutenção de fundo (consulte a Tabela 31).
Tabela 31: taxa anual de moderadaa ou graveb Exacerbações de DPOC em ensaios de Boreas e Notus
| Julgamento | Tratamento (N) | Taxa (exacerbações/ano) | Taxa de taxa vs. placebo (IC 95%) |
| Norte | Dupixent 300 mg Q2W (N=468) | 0.78 | 0.71 (0,58 0,86) |
| Placebo (N=471) | 1.10 | ||
| Conhecido | Dupixent 300 mg Q2W (N=470) | 0.86 | 0.66 (0,54 0,82) |
| Placebo (N=465) | 1.30 | ||
| a Exacerbações tratadas com corticosteróides sistêmicos e/ou antibióticos. b Exacerbações que exigem hospitalização ou observação por mais de 24 horas em um departamento de emergência ou instalação de atendimento urgente ou resultando em morte. |
Tratamento with Dupixent decreased the risk of a moderate to severe COPD exacerbation as measured by time to first exacerbation when compared with placebo in Norte (HR: 0.80; 95% CI: 0.66 0.98) e Conhecido (HR: 0.71; 95% CI: 0.57 0.89).
Função pulmonar em indivíduos adultos com DPOC
Nos dois ensaios (Boreas e Notus) Dupixent demonstrou melhoria numérica no pós-broncodilatador FEV1 Nas semanas 12 e 52 em comparação ao placebo quando adicionado à terapia de manutenção de fundo (consulte a Tabela 32 e a Figura 17). Melhorias significativas de magnitude semelhante foram observadas na mudança da linha de base no FEV pré-broncodilatador1 Nas semanas 12 e 52 em indivíduos tratados com dupixent em comparação com o placebo em ambos os ensaios.
Tabela 32: Mudança média da linha de base e diferença no pós-broncodilatador FEV1 nas semanas 12 e 52 em ensaios de Boreas e Notus para DPOC
| Julgamento | Tratamento (N) | LS significa mudança em relação ao ML da linha de base | LS Diferença média vs. placebo ml (IC 95%) |
| Pós-broncodilatador Fevi na semana 12 | |||
| Norte | Dupixent 300 mg Q2W (N=468) | 158 | 74 (31 117) |
| Placebo (N=471) | 84 | ||
| Conhecido | Dupixent 300 mg Q2W (N=470) | 134 | 68 (26 110) |
| Placebo (N=465) | 67 | ||
| Pós-broncodilatador Fevi na semana 52 | |||
| Norte | Dupixent 300 mg Q2W (N=468) | 138 | 79 (34 124) |
| Placebo (N=471) | 58 | ||
| Conhecidoa | Dupixent 300 mg Q2W (N=362) | 127 | 67 (16 119) |
| Placebo (N=359) | 59 | ||
| a Resultados de eficácia para mudança média da linha de base no pós-broncodilatador FEV1 Na semana 52, são apresentados para 721 dos 935 indivíduos que concluíram o período de tratamento de 52 semanas ou interromperam o estudo no momento da análise dos dados. |
Figura 17: LS Média média da linha de base no pós-broncodilatador FEV1 (ML) Com o tempo em Boreas e Notusa Julgamentos for COPD
| 1 (mL) Over Time in BOREAS and NOTUSa Trials for COPD Illustration' src='//apotheke.buzz/img/interleukin-inhibitors/38/dupixent-16.webp' > |
a Resultados de eficácia para mudança média da linha de base no pós-broncodilatador FEV1 Com o tempo, são apresentados 721 dos 935 indivíduos que concluíram o período de tratamento de 52 semanas ou interromperam o estudo no momento da análise de dados.
Qualidade de vida relacionada à saúde
Em ambos os ensaios (Boreas e Notus), foi avaliado o questionário respiratório de St. George (SGRQ) (definido como a proporção de indivíduos com melhoria do SGRQ da linha de base de pelo menos 4 pontos) na semana 52 foi avaliada. Em boreas, a taxa de resposta foi de 51% para indivíduos tratados com dupixent versus 43% para placebo (n = 939 odds ratio: 1,44; IC 95%: 1,10 1,89). Em Notus, a taxa de resposta foi de 51% para indivíduos tratados com dupixent versus 47% para placebo (n = 721 odds ratio: 1,16; IC 95%: 0,86 1,58).
Urticária espontânea crônica
The efficacy of DUPIXENT for the treatment of adult and pediatric patients aged 12 years and older with chronic spontaneous urticaria who remain symptomatic despite H1 antihistamine treatment was evaluated in a master protocol clinical trial (CUPID [NCT04180488]) that included three 24-week randomized double-blind parallel-group multicenter placebocontrolled trials (CUPID Study A Study B and Study C) followed por períodos de acompanhamento de segurança cegos de 12 semanas. O estudo do cupido A e o estudo C incluíram indivíduos que permaneceram sintomáticos, apesar do tratamento anti-histamínico de H1 e foram o tratamento anti-IGE naã, enquanto o estudo do cupido B incluía pacientes que permaneceram sintomáticos apesar dos tratamentos anti-histamínicos e anti-IgE H1. A eficácia do dupixent foi baseada apenas no estudo do cupido A e no estudo C; O estudo B não atendeu ao ponto final primário.
Cupido Study A e Study C
Um total de 284 pacientes adultos e pediátricos com 12 anos de idade ou mais com CSU (pontuação de gravidade de coceira em 7 dias (ISS7) ≥8 em uma escala de 0 a 21 e a pontuação da atividade de urticária em 7 dias (UAS7) ≥16 em uma escala de 0 a 42) que o uso de h1 de h1 de h1 de cem de uma escala que era de 42) que o uso de h1 de h1), que foi o tempo de histamina, que era o que era o uso de histaminas de H1, mas de cem de um cem-ri-ri. adultos em grupo e indivíduos pediátricos (com 12 anos de idade e mais) pesando ≥60 kg receberam uma dose subcutânea de dupixent 600 mg no dia 1, seguido de 300 mg a cada 2 semanas (Q2W), enquanto o Pediatric Indivesa (12 anos de idade e mais) pesando 30 kg a menos de 60 kg recebido por um subcutâneo (12 anos de idade e mais de 30 kg a 1 mg. As características demográficas e basais da população de eficácia no Cupido Study A e Study C são fornecidas na Tabela 33.
Tabela 33: Demografia e características de linha de base dos indivíduos com CSU no Cupido Study A e Study C
| Estudo do Cupido a (N = 136) | Estudo do Cupido c (N = 148) | |
| Idade média (anos) (DP) | 42 (15.1) | 46 (16,3) |
| % Fêmea | 66 | 70 |
| % Branco | 68 | 45 |
| % Asiático | 26 | 42 |
| % Preto | 2 | 1 |
| % Hispânico ou latino | 18 | 16 |
| Peso corporal médio (kg) | 77 | 74 |
| Média ISS7 | 16 | 15.1 |
| Significa UAS7 | 31.4 | 28.2 |
| HSS7 médio | 15.4 | 13.1 |
| % indivíduos com UAS7 ≥28 | 70.6 | 58.8 |
| Mediana Total IGE IU/ML (Q1Q3) | 101 (40,3 252) | 108 (37 309) |
| ISS7 = Pontuação de gravidade da coceira em 7 dias; UAS7 = Pontuação da atividade da urticária em 7 dias; HSS7 = Pontuação de gravidade de colméias ao longo de 7 dias; H1ah = H1 anti -histamínico; Q1 = 1º quartil; Q3 = 3º quartil |
O endpoint primário foi a mudança da linha de base na pontuação da gravidade da coceira em 7 dias (ISS7) na semana 24. A pontuação do ISS7 foi definida como a soma dos escores diários de gravidade da coceira (ISS) de 0 a 3 registrados na mesma hora do dia durante um período de 7 dias variando de 0 a 21.
O principal ponto final secundário foi a mudança da linha de base na pontuação da atividade da urticária em 7 dias (UAS7) na semana 24. O UAS7 (intervalo de 0 a 42) foi um composto da pontuação semanal de gravidade da coceira (intervalo de ISS7 de 0 a 21) e a pontuação semanal da contagem de colméias (intervalo de HSS7 de 0 a 21).
Os resultados para pontos de extremidade primária e secundária no Cupid Study A e Study C são apresentados na Tabela 34.
Tabela 34: Eficácia resulta em indivíduos com CSU no Cupido Study A e Study C
| Estudo do Cupido a | Estudo do Cupido c | |||||
| Dupixent (N = 68) | Placebo (N = 68) | Dupixent vs. Placebo (95% CI) | Dupixent (N = 73) | Placebo (N = 75) | Dupixent vs. Placebo (95% CI) | |
| Endpoint primário | ||||||
| Mudança da linha de base no ISS7 na semana 24a | -10.44 (0,92) | -6.02 (0,94) | -4.42 (-6,84 -2,01)b | -8.50 (1,39) | -6.13 (1,38) | -2.37 (-4,48 -0,27)b |
| Terminais secundários | ||||||
| Mudança em relação à linha de base no UAS7 na semana 24a | -20.99 (1,77) | -11.95 (1.81) | -9.04 (-13,68 -4,40)b | -15.61 (2.62) | -11.27 (2.61) | -4.34 (-8,31 -0,36)b |
| Mudança da linha de base no HSS7 na semana 24a | -10.54 (0,91) | -5.85 (0,93) | -4.69 (-7,08 -2,30)b | -7.16 (1,30) | -5.15 (1,29) | -2.01 (-3,98 -0.04)b |
| Proporção de pacientes com UAS7 ≤6 na semana 24a | 32 (47.1) | 16 (23.5) | 3.23 (1,43 7.27)c | 29 (39,7) | 17 (22,7) | 3.05 (1,32 7,02)c |
| Proporção de pacientes com UAS7 = 0 na semana 24a | 22 (32.4) | 9 (13.2) | 3.09 (1,24 7,69)c | 22 (30.1) | 13 (17.3) | 2.73 (1,15 6,50)c |
| a Os valores apresentados são alterações médias de LS em relação à linha de base (SE) para variáveis contínuas e número e porcentagem de respondedores para variáveis binárias. b Os valores apresentados são diferenças médias de LS. c Os valores apresentados são odds ratios. |
Estudo do Cupido a showed significant improvement in ISS7 e UAS7 from baseline na semana 12 in the Dupixent group (LS mean difference Dupixent versus placebo of -2.53 [95% CI: (-4.79 -0.27)] for ISS7 e -5.44 [95% CI: (-9.77 -1.11)] for UAS7). The proportion of patients with UAS7 ≤6 na semana 12 in Estudo do Cupido a was 35.3% in the Dupixent group e 17.6% in the placebo group (Odds Ratio: 2.79 [95% CI: (1.22 6.40)]).
As alterações médias no ISS7 ao longo do tempo no Cupid Study A e o Study C são mostradas na Figura 18.
Figura 18: LS Média média da linha de base no ISS7 em 24 semanas no Cupido Study A e Study C
 |
Alterações semelhantes em UAS7 e HSS7 foram observadas em 24 semanas.
As melhorias no ISS7 e UAS7 na semana 24 foram consistentes, independentemente dos pacientes '
Estudo do Cupido b
Estudo do Cupido b enrolled 108 adult e pediatric patients 12 years of age e older with CSU who were inadequate responders (N=104) to H1 antihistamines e anti-IgE treatments or intolerant (N=4) to anti-IgE therapy. At baseline the mean ISS7 was 16 mean UAS7 score was 31.5 e the mean HSS7 was 15.4. The majority of participants (69.4%) had a UAS7 score of ≥28 at baseline. The median (Q1 Q3) total IgE (IU/mL) at baseline was 77 (20 204.5). Estudo do Cupido b evaluated efficacy using the same primary e secondary endpoints as Estudo do Cupido a e Study C. The Dupixent group in Estudo do Cupido b did not meet statistical significance for reduction in the primary endpoint ISS7 at Week 24.
Informações do paciente para dupixent
Dupixent®
(Du-pix-ent)
(dupilumab) injeção para uso subcutâneo
O que é dupixent?
Dupixent is a prescription medicine used:
- Tratar adultos e crianças com 6 meses de idade ou mais com eczema moderado a grave (dermatite atópica ou DA) que não é bem controlada com terapias com prescrição usadas na pele (tópica) ou que não podem usar terapias tópicas. O dupixent pode ser usado com ou sem corticosteróides tópicos.
- Com outros medicamentos para asma para o tratamento de manutenção de asma moderada a grave em adultos e crianças de 6 anos e mais de idade, cuja asma não é controlada com seus medicamentos atuais sobre asma. O Dupixent ajuda a evitar ataques graves de asma (exacerbações) e pode melhorar sua respiração. O Dupixent também pode ajudar a reduzir a quantidade de corticosteróides orais necessários, evitando ataques graves da asma e melhorando sua respiração.
- Com outros medicamentos para o tratamento de manutenção da rinossinusite crônica com pólipos nasais (CRSWNP) em adultos e crianças com 12 anos de idade e mais de idade, cuja doença não é controlada.
- Tratar adultos e crianças com 1 ano de idade ou mais com esofagite eosinofílica (EOE) que pesam pelo menos 15 kg (15 kg).
- tratar adultos com prurigo nodularis (PN).
- com outros medicamentos para o tratamento de manutenção de adultos com doença pulmonar obstrutiva crônica controlada inadequadamente controlada (DPOC) e um alto número de eosinófilos sanguíneos (um tipo de glóbulo branco que pode contribuir para a sua DPOC). O Dupixent é usado para reduzir o número de surtos (a piora dos sintomas da DPOC por vários dias) e pode melhorar sua respiração.
- Tratar a urticária espontânea crônica (CSU) em adultos e crianças de 12 anos ou mais que continuam a ter colméias que não são controladas com o tratamento anti -histamínico de H1.
- Dupixent is not used to relieve sudden breathing problems e will not replace an inhaled rescue medicine.
- Dupixent is not used to treat any other forms of urticária (urticaria).
- Dupixent works by blocking two proteins that contribute to a type of inflammation that plays a major role in atopic dermatitis asthma chronic rhinosinusitis with nasal polyps eosinophilic esophagitis prurigo nodularis chronic obstructive pulmonary disease e chronic spontaneous urticaria.
- Não se sabe se o dupixent é seguro e eficaz em crianças com dermatite atópica com menos de 6 meses de idade.
- Não se sabe se o Dupixent é seguro e eficaz em crianças com asma com menos de 6 anos de idade.
- Não se sabe se o dupixent é seguro e eficaz em crianças com rinossinusite crônica com pólipos nasais com menos de 12 anos de idade.
- Não se sabe se o dupixent é seguro e eficaz em crianças com esofagite eosinofílica com menos de 1 ano de idade ou que pesam menos de 15 kg (15 kg).
- Não se sabe se o dupixent é seguro e eficaz em crianças com prurigo nodularis com menos de 18 anos de idade.
- Não se sabe se o dupixent é seguro e eficaz em crianças com doença pulmonar obstrutiva crônica com menos de 18 anos de idade. A doença pulmonar obstrutiva crônica é mais frequentemente vista em adultos.
- Não se sabe se o dupixent é seguro e eficaz em crianças com urticária espontânea crônica com menos de 12 anos de idade ou que pesam menos de 30 kg (30 kg).
Não use dupixent Se você é alérgico ao dupilumab ou a qualquer um dos ingredientes no dupixent. Veja o final deste folheto de informações do paciente para obter uma lista completa de ingredientes no dupixent.
Antes de usar o Dupixent, informe ao seu médico sobre todas as suas condições médicas, incluindo se você:
- tem problemas oculares.
- Tenha uma infecção parasitária (helminto).
- estão programados para receber quaisquer vacinas. Você não deve receber uma vacina viva logo antes e durante o tratamento com dupixent.
- estão grávidas ou planejam engravidar. Não se sabe se o Dupixent prejudicará seu bebê ainda não nascido.
Gravidez Exposure Registry. Há um registro de exposição à gravidez para mulheres que usam dupixent durante a gravidez. O objetivo deste registro é coletar informações sobre a saúde de você e seu bebê. Seu provedor de saúde pode matricular você neste registro. Você também pode se inscrever ou obter mais informações sobre o registro, ligando para 1-877-311-8972 ou indo para https://mothertobaby.org/ongoing-study/dupixent/. - estão amamentando ou planejam amamentar. Não se sabe se o dupixent passa para o seu leite materno.
Diga ao seu provedor de saúde sobre todos os medicamentos que você toma, incluindo receita médica e vitaminas e suplementos de ervas de receita médica.
Diga especialmente ao seu médico se você:
- estão tomando medicamentos de corticosteróides tópicos ou inalados orais
- tem asma e use um remédio para asma
- têm dermatite atópica rinossinusite crônica com pólipos nasais eosinofílicos esofagite prurigo nodularis doenças pulmonares obstrutivas crônicas ou urticária espontânea crônica e também têm asma
Não Mude ou pare seus outros medicamentos, incluindo medicina de corticosteróide ou outro medicamento para asma sem conversar com seu médico. Isso pode causar outros sintomas controlados por esses medicamentos para voltar.
Como devo usar o dupixent?
- Consulte as instruções detalhadas para uso que acompanham o Dupixent para obter informações sobre como preparar e injetar o Dupixent e como armazenar e jogar fora (descartar) usou seringas pré-cheias de dupixent usadas e canetas pré-preenchidas.
- Use o Dupixent exatamente como prescrito pelo seu profissional de saúde.
- Seu provedor de saúde dirá quanto dupixent injetar e com que frequência o injeta.
- Dupixent comes as a single-dose pre-filled syringe with needle shield or as a pre-filled pen.
- A caneta pré-preenchida dupixent é apenas para uso em adultos e crianças com 2 anos de idade ou mais.
- A seringa pré-cheia de dupixent é para uso em adultos e crianças com 6 meses de idade ou mais.
- Dupixent is given as an injection under the skin (subcutaneous injection).
- Se o seu prestador de serviços de saúde decidir que você ou um cuidador poderá dar as injeções de dupixent, você ou seu cuidador devem receber treinamento na maneira certa de preparar e injetar o Dupixent. Não tente injetar o dupixent até receber o caminho certo pelo seu provedor de saúde. Em crianças de 12 anos ou mais, é recomendável que o Dupixent seja dado por ou sob a supervisão de um adulto. Em crianças de 6 meses a menos de 12 anos de idade, o dupixent deve ser dado por um cuidador.
- Se o seu cronograma de dose for toda semana e você perder uma dose de dupixent: Dê a injeção do dupixent o mais rápido possível e inicie um novo cronograma de dose toda semana a partir do momento em que você se lembra de tomar sua injeção de dupixent.
- Se o seu cronograma de dose for a cada 2 semanas e você perder uma dose de dupixent: Dê a injeção dupixent dentro de 7 dias após a dose perdida e continue com sua programação original. Se a dose perdida não for dada dentro de 7 dias, espere até a próxima dose programada para dar sua injeção de dupixent.
- Se o seu cronograma de dose for a cada 4 semanas e você perder uma dose de dupixent: Dê a injeção dupixent dentro de 7 dias após a dose perdida e continue com sua programação original. Se a dose perdida não for dada dentro de 7 dias, inicie um novo cronograma de dose a cada 4 semanas a partir do momento em que você se lembra de tomar sua injeção de dupixent.
- Se você injetar muito dupixent, ligue para o seu profissional de saúde ou venese a linha de ajuda em 1-800-222-1222 ou vá para a sala de emergência do hospital mais próxima imediatamente.
- Seu médico pode prescrever outros medicamentos para usar com o Dupixent. Use os outros medicamentos prescritos exatamente como seu médico disser.
Quais são os possíveis efeitos colaterais do dupixent?
Dupixent can cause serious side effects including:
- Reações alérgicas. O dupixent pode causar reações alérgicas que às vezes podem ser graves. Pare de usar o Dupixent e informe seu médico ou obtenha ajuda de emergência imediatamente se você receber algum dos seguintes sinais ou sintomas:
- Problemas respiratórios ou chiado
- pulso rápido
- febre
- sentimento geral
- linfonodos inchados
- inchaço dos lábios da língua ou garganta da boca dos lábios
- urticária
- coceira
- náusea ou vômito
- desmaiando tontura sentindo -se tontura
- dor nas articulações
- erupção cutânea
- cólicas na sua área de estômago
- Problemas oculares. Diga ao seu médico se você tiver algum problema ocular novo ou pior, incluindo dor ocular ou mudanças na visão, como a visão turva. Seu médico pode enviá -lo a um oftalmologista para um exame oftalmológico, se necessário.
- Inflamação de seus vasos sanguíneos. Raramente isso pode acontecer em pessoas com asma que recebem dupixent. Isso pode acontecer em pessoas que também tomam um remédio para esteróides por via oral que está sendo interrompida ou a dose está sendo reduzida. Diga ao seu médico imediatamente, se você tiver:
- irritação na pele
- piora a falta de ar
- febre persistente
- dor no peito
- urina marrom ou escura
- uma sensação de alfinetes e agulhas ou dormência de seus braços ou pernas
- Psoríase. Isso pode acontecer em pessoas com dermatite atópica e asma que recebem dupixent. Diga ao seu provedor de saúde sobre quaisquer novos sintomas da pele. Seu médico pode enviá -lo a um dermatologista para um exame, se necessário.
- Dores e dor articulares. Dores e dor nas articulações podem acontecer em pessoas que usam dupixent. Algumas pessoas tiveram problemas para caminhar ou se mover devido aos sintomas conjuntos e, em alguns casos, precisavam ser hospitalizados. Diga ao seu médico sobre quaisquer sintomas articulares novos ou agravados. Seu médico pode interromper o dupixent se você desenvolver sintomas conjuntos.
Os efeitos colaterais mais comuns do dupixent incluem:
- Reações do local da injeção
- infecções do trato respiratório superior
- inflamação ocular e pálpebra, incluindo inchaço e coceira às vezes com visão turva
- olho seco
- infecções por vírus do herpes
- sintomas de resfriado comuns (nasofaringite)
- feridas frias na sua boca ou em seus lábios
- alta contagem de um certo glóbulo branco (eosinofilia)
- infecção viral
- dor nas costas
- Inflamação dentro do nariz (rinite)
- tontura
- dor muscular
- diarréia
- dor na garganta (dor orofaríngea)
- gastrite
- dor nas articulações (arthralgia)
- Problemas para dormir (insônia)
- dor de dente
- Infecções parasitas (helmintos)
- dor de cabeça
- infecção do trato urinário
Os seguintes efeitos colaterais adicionais foram relatados com Dupixent:
- Erupção facial ou inflamação de vermelhidão de seus vasos sanguíneos na pele
Diga ao seu médico se você tiver algum efeito colateral que o incomoda ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do dupixent.
Ligue para o seu médico para obter conselhos médicos sobre efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar dupixent?
- Armazene o dupixent na geladeira entre 36 ° F a 46 ° F (2 ° C a 8 ° C).
- Armazene dupixent na caixa original para proteger da luz.
- Dupixent can be stored at room temperature up to 77°F (25°C) up to 14 days. Throw away (dispose of) any Dupixent that has been left at room temperature for longer than 14 days.
- Não Aqueça ou coloque dupixent na luz solar direta.
- Não congelar. Não sacudir.
Mantenha o Dupixent e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz do dupixent.
Às vezes, os medicamentos são prescritos para outros fins que não os listados em um folheto de informações do paciente. Não use Dupixent para uma condição para a qual não foi prescrito. Não dê dupixent a outras pessoas, mesmo que elas tenham os mesmos sintomas que você tem. Isso pode prejudicá -los. Você pode solicitar ao seu farmacêutico ou prestador de serviços de saúde informações sobre o Dupixent que estão escritas para profissionais de saúde.
Quais são os ingredientes em dupixent?
Ingrediente ativo: dupilumab
Ingredientes inativos: Polisorbato de cloridrato de L-arginina L-histidina 8 80 sacarose de acetato de sódio e água para injeção.
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.