Fiasp
As Informações Neste Site Não Constituem Aconselhamento Médico. Não Vendemos Nada. A Precisão Da Tradução Não É Garantida. Isenção De Responsabilidade
Resumo das drogas
O que é fiasp?
Fiasp (injeção de insulina aspart) é um análogo de insulina humana de ação rápida indicada para melhorar o controle glicêmico em adultos com Diabetes mellitus .
Quais são os efeitos colaterais do fiasp?
Fiasp
- urticária
- dificuldade em respirar
- inchaço da língua ou garganta dos lábios do seu rosto
- tontura
- boca seca
- pele seca
- odor de respiração frutado
- náusea
- dor no estômago
- aumento da fome ou sede
- aumento da micção
- ansiedade
- confusão
- tontura
- aumento da fome
- extraordinariamente fraqueza
- cansaço
- suando
- Shakakess
- Sentindo frio
- irritável
- dor de cabeça
- visão turva
- batimento cardíaco rápido e
- perda de consciência
Obtenha ajuda médica imediatamente se tiver algum dos sintomas listados acima.
Os efeitos colaterais comuns do fiasp incluem:
- baixo açúcar no sangue ( Hipoglicemia )
- reações alérgicas
- Hipersensibilidade
- Reações do local da injeção
- Distribuição anormal da gordura corporal
- ganho de peso
- escorrendo ou nariz entupido
- infecção do trato respiratório superior
- náusea diarrhea
- dor nas costas
- e infecção do trato urinário (UTI).
Procure cuidados médicos ou ligue para o 911 de uma só vez, se tiver os seguintes efeitos colaterais graves:
- Sintomas graves oculares, como perda súbita de visão de visão, visão de visão da visão ou inchaço ou vendo halos ao redor das luzes;
- Sintomas cardíacos graves, como batimentos cardíacos irregulares ou batendo rápidos; flutuando no seu peito; falta de ar; e tontura repentina Tardete ou desmaiar;
- Confusão de dor de cabeça grave arborizada braço de fala ou fraqueza da perna TROBLEMENTO A perda de coordenação sentindo músculos instáveis muito rígidos, febre alta, sudorese ou tremores.
Este documento não contém todos os efeitos colaterais possíveis e outros podem ocorrer. Verifique com seu médico para obter informações adicionais sobre efeitos colaterais.
Dose para fiasp
A dose de fiasp é individualizada e ajustada com base na rota de administração das necessidades metabólicas do indivíduo glicose no sangue Monitorando os resultados e objetivo de controle glicêmico.
Quais medicamentos substâncias ou suplementos interagem com fiasp?
Fiasp pode interagir com:
- Agentes antidiabéticos
- Inibidores da ECA
- Agentes de bloqueio de receptores da angiotensina II (ARBs)
- disopiramida
- fibra
- Fluoxetina
- Inibidores da monoamina oxidase (MAOIS)
- pentoxifilina
- Pramlintide
- salicilatos
- Análogos da somatostatina
- drogas sulfa
- Antipsicóticos atípicos
- corticosteróides
- Danazol
- diuréticos
- Estrógenos
- Glucagon
- isoniazid
- niacina
- contraceptivos orais
- Fenotiazinas
- Proastógenos
- Inibidores de protease
- Somatropina
- agentes simpatomiméticos
- Hormônios da tireóide
- álcool
- Betabloqueadores
- Clonidina
- sais de lítio
- Pentamidina
- Guanetidina
- e Reserpine.
Diga ao seu médico todos os medicamentos e suplementos que você usa.
Fiasp durante a gravidez e amamentação
Diga ao seu médico se você está grávida ou planeja engravidar antes de usar Fiasp; Não se sabe como isso afetaria um feto. Não se sabe se Fiasp passa para o leite materno. Consulte seu médico antes de amamentar.
Informações adicionais
Nosso Centro de Medicamentos FIAsp (Insulina Aspart Injeção) fornece uma visão abrangente das informações disponíveis dos medicamentos sobre os possíveis efeitos colaterais ao tomar este medicamento.
Informações sobre medicamentos da FDA
- Descrição do medicamento
- Indicações
- Efeitos colaterais
- Interações medicamentosas
- Avisos
- Overdose
- Farmacologia Clínica
- Guia de medicação
Descrição para Fiasp
O FIASP (injeção de insulina aspart) é um análogo de insulina de ação rápida para administração subcutânea ou intravenosa usada para diminuir a glicose no sangue. A insulina aspart é homóloga com insulina humana regular, com exceção de uma única substituição do prolina de aminoácidos pelo ácido aspártico na posição B28 e é produzido pela tecnologia de DNA recombinante utilizando Saccharomyces cerevisiae . Insulina Aspart tem a fórmula empírica C256H381N65079S6 e um peso molecular de 5825,8 daltons.
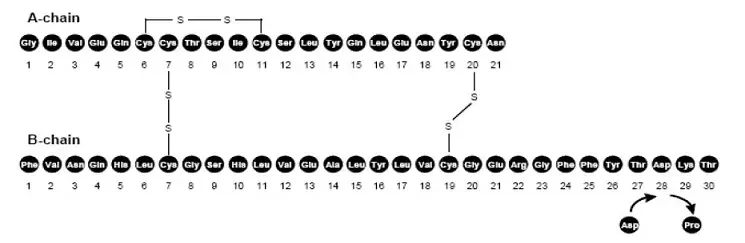 |
Figura 1. Fórmula estrutural de insulina aspart
O FIASP é uma solução aquosa clara e incolor estéril que contém insulina aspart 100 unidades/ml de glicerol fenol metacresol zinco fosfato de fosfato de di -hidrato arginina niacinamida (vitamina B3) e água para injeções. Fiasp tem um pH de 7,1. O ácido clorídrico e/ou o hidróxido de sódio podem ser adicionados para ajustar o pH.
Usos para fiasp
O FIASP é indicado para melhorar o controle glicêmico em pacientes adultos e pediátricos com diabetes mellitus.
Dose para fiasp
Instruções importantes de preparação e administração
- Sempre verifique o rótulo de insulina antes da administração [veja Avisos e precauções ].
- Inspecione fiasp visualmente antes do uso. Deve parecer claro e incolor. Não use fiasp se o material particulado ou a coloração for visto.
- Use a caneta Fiasp Flextoch com cautela em pacientes com deficiência visual que podem confiar em cliques audíveis para discar sua dose.
- Use cartuchos de preenchimento com cautela em pacientes com deficiência visual.
- Não misture fiasp com nenhuma outra insulina.
Route de instruções de administração
Injeção subcutânea
- Injete fiasp no início de uma refeição ou dentro de 20 minutos depois de iniciar uma refeição subcutânea no braço ou na coxa do abdômen.
- Gire os locais de injeção na mesma região de uma injeção para a próxima para reduzir o risco de lipodistrofia e amiloidose cutânea localizada. Não injete em áreas de lipodistrofia ou amiloidose cutânea localizada [ver Reações adversas ].
- A fiasp dada por injeção subcutânea geralmente deve ser usada em regimes com insulina intermediária ou de ação prolongada.
- Instrua os pacientes no tratamento do bolo basal que esquecem uma dose de refeição para monitorar seu nível de glicose no sangue para decidir se é necessária uma dose de insulina e a retomar seu cronograma habitual de dosagem na próxima refeição.
- O fiasp flextoouch projeta os mostradores em 1 incrementos de unidade.
Infusão subcutânea contínua (bomba de insulina)
- Consulte o manual do usuário da bomba de infusão de insulina subcutânea contínua para verificar se Fiasp ou Fiasp Pumpcart pode ser usado com a bomba de insulina. Use o FIASP e o FIASP Pumpcart de acordo com as instruções do sistema de insulina bomba para uso.
- Administre fiasp por infusão subcutânea contínua em uma região recomendada nas instruções do fabricante da bomba. Gire os locais de infusão na mesma região para reduzir o risco de lipodistrofia e amiloidose cutânea localizada. Não se infunda em áreas de lipodistrofia ou amiloidose cutânea localizada [ver Avisos e precauções Reações adversas ].
- Treinar pacientes usando terapia subcutânea contínua de infusão de insulina para administrar insulina por injeção e ter terapia alternativa à insulina disponível em caso de falha na bomba de insulina [ver Avisos e precauções ].
- Altere o FIASP no reservatório da bomba pelo menos a cada 6 dias ou substitua o cartucho da bomba pelo menos a cada 4 dias ou de acordo com o manual do usuário da bomba, o que for mais curto. Siga as informações específicas do FIASP para o tempo em uso, porque as informações específicas do FIASP podem diferir das instruções do Manual de Usuário da Bomba Geral de Insulina.
- Altere os conjuntos de infusão e o local de inserção do conjunto de infusão de acordo com o manual do usuário do fabricante.
- Não se misture com outras insulinas ou diluentes na bomba de insulina.
- Não exponha a fiasp no reservatório da bomba a temperaturas superiores a 37 ° C (98,6 ° F).
Administração intravenosa
- Administre fiasp por via intravenosa apenas sob supervisão médica com monitoramento próximo dos níveis de glicose no sangue e potássio para evitar hipoglicemia e hipocalemia [ver Avisos e precauções ].
- Diluta fiasp em concentrações de 0,5 unidade/ml a 1 unidade/ml de insulina aspart em sistemas de infusão usando sacos de infusão de polipropileno.
- O FIASP é estável à temperatura ambiente a 20 ° C a 25 ° C (68 ° F a 77 ° F) por 24 horas em cloreto de sódio a 0,9% ou fluidos de infusão de dextrose a 5%.
Recomendações de dosagem
- Individualizar a dose de fiasp com base na rota de administração do paciente, as metabólicas das necessidades de glicose no sangue e a meta de controle glicêmico.
- Se a conversão de outra insulina da hora das refeições para fiasp, a alteração inicial pode ser feita de maneira unitária a unidade.
- Os ajustes da dose podem ser necessários ao alternar de outra insulina com mudanças nas mudanças de atividade física nos medicamentos concomitantes mudanças nos padrões de refeições (ou seja, conteúdo de macronutrientes ou tempo da ingestão de alimentos) mudanças na função renal ou hepática ou durante doenças agudas para minimizar o risco de hipoglicemia ou hiperglicemia [ver verifique Avisos e precauções e Interações medicamentosas e Use em populações específicas ].
- Monitore de perto a glicose no sangue ao converter insulinas usadas nas bombas de insulina, pois a individualização dos parâmetros da bomba de insulina pode ser necessária para minimizar o risco de hipoglicemia e hiperglicemia [ver [ver Avisos e precauções e Reações adversas ]
- Durante as mudanças no regime de insulina de um paciente, aumente a frequência do monitoramento de glicose no sangue [ver Avisos e precauções ].
- O ajuste da dose pode ser necessário quando Fiasp é co-administrado com certos medicamentos [ver Interações medicamentosas ].
Como fornecido
Formas e forças de dose
Injeção: 100 unidades de insulina aspart por ml (Sub-100) estão disponíveis como uma solução clara e incolor em:
- 10 ml de frasco de dose múltipla
- 3 mL de caneta Fiasp FiaxTouch
- Cartuchos de Penfill de uso único de 3 ml para uso em um dispositivo de entrega de cartucho de penfill
- 1,6 ml de cartuchos de bomba de uso único de uso único para uso em uma bomba de insulina compatível.
Armazenamento e manuseio
Injeção de fiasp (insulina aspart) 100 unidades de insulina aspart por ml (Sub-100) estão disponíveis como uma solução clara e incolor nas seguintes apresentações e configurações de embalagem:
Carton de um 10 ml de frascos de doses múltiplas NDC 0169-3201-11
Carton de cinco canetas Fiasp Faspouch de 3 ml de uso único NDC 0169-3204-15
Carton de cinco cartuchos de preenchimento de uso único de 3 ml de uso único* NDC 0169-3205-15
Carton de cinco cartuchos de bomba de uso único de 1,6 ml de uso único ** ** NDC 0169-3206-15
O fiasp flextoouch projeta os mostradores em 1 incrementos de unidade.
* Os cartuchos Penfill FIASP são projetados para uso com dispositivos de entrega de insulina de Nordisk Novo.
** Os cartuchos FIAsp Pumpcart são projetados apenas para uso em bombas compatíveis.
Armazenamento recomendado
Dispense a caixa original selada com as instruções fechadas para uso.
Os frascos de fiasp não utilizados devem ser armazenados entre 2 ° e 8 ° C (36 ° a 46 ° F) em uma geladeira, mas não dentro ou perto de um compartimento de congelamento. O fiasp não deve ser exposto ao calor ou luz excessivo e nunca deve ser congelado. Não use fiasp se tiver sido congelado. O FIASP não deve ser desenhado em uma seringa e armazenado para uso posterior.
Mantenha a tampa da caneta para proteger da luz. Remova a agulha da caneta Fiasp Flextouch após cada injeção e guarde sem uma agulha presa. Use uma nova agulha para cada injeção.
Mantenha os frascos não utilizados fiasp Flextouch Penfill Cartures e cartuchos de bomba na caixa para que permaneçam limpos e protegidos da luz.
As condições de armazenamento para os frascos FIAsp FlexTouch canetas 3 ml cartuchos de penfill e os cartuchos de 1,6 ml de bomba estão resumidos na Tabela 12:
Tabela 12: Condições de armazenamento para o frasco Fiasp Flextouch Penfill Cartuchos e cartuchos de bombeamento
| Apresentação FIASP | Não em uso (fechado) | Em uso (aberto) | ||
| Temperatura ambiente (até 30 ° C [86 ° F]) | Refrigerado (2 ° C a 8 ° C [36 ° F a 46 ° F]) | Temperatura ambiente (até 30 ° C [86 ° F]) | Refrigerado (2 ° C a 8 ° C [36 ° F a 46 ° F]) | |
| 10 ml de frasco de dose múltipla | 28 dias | Até a data de validade | 28 dias* (up to 30°C [86°F]) | 28 dias* |
| 3 mL de caneta Fiasp FiaxTouch | 28 dias | Até a data de validade | 28 dias (up to 30°C [86°F]) | 28 dias |
| 3 ml de cartuchos de preenchimento de uso único | 28 dias | Até a data de validade | 28 dias (up to 30°C [86°F]) | Não refrigerar |
| 1,6 mL de cartuchos de bomba de uso único | 18 dias ** | Até a data de validade | 4 dias ** (até 37 ° C [98,6 ° F]) | Não refrigerar |
| *Reservatório da bomba: o tempo total em uso é de 28 dias, incluindo 6 dias no reservatório da bomba ** Cartuchos de bomba: o tempo máximo à temperatura ambiente é de 18 dias, incluindo 4 dias na bomba |
Armazenamento de fiasp na bomba de insulina
- Altere o FIASP no reservatório da bomba pelo menos a cada 6 dias ou de acordo com o manual do usuário da bomba, o que for mais curto.
- Substitua o cartucho FIAsp Pumpcart pelo menos a cada 4 dias ou de acordo com o manual do usuário da bomba, o que for mais curto.
- Altere o FIASP para evitar a degradação da insulina ou após a exposição a temperaturas que excedem 37 ° C (98,6 ° F).
- O conjunto de infusão e os locais de inserção do conjunto de infusão devem ser alterados de acordo com o manual do usuário dos fabricantes.
Armazenamento de fiasp em fluidos de infusão intravenosa
Os sacos de infusão preparados conforme indicado sob dosagem e administração (2.2) são estáveis à temperatura ambiente a 20 ° C a 25 ° C (68 ° F a 77 ° F) por 24 horas.
Fabricado por: Novo Nordisk Inc. 800 Scudders Mill Road Plainsboro New Jersey 08536 Licença dos EUA 1261. Revisado: junho de 2023
Efeitos colaterais for Fiasp
As seguintes reações adversas clinicamente significativas são descritas em outros lugares na rotulagem:
- Hiperglicemia ou hipoglicemia com mudanças no regime de insulina [ver Avisos e precauções ]
- Hipoglicemia [Veja Avisos e precauções ]
- Hipocalemia [ver Avisos e precauções ]
- Hipersensibilidade e reações alérgicas [ver Avisos e precauções ]
Experiência em ensaios clínicos
Como os ensaios clínicos são conduzidos sob condições amplamente variadas, as taxas de reação adversa observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparados às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas realmente observadas na prática clínica.
Os dados da Tabela 1 refletem a exposição de 763 pacientes adultos com diabetes mellitus tipo 1 a fiasp em um ensaio clínico com uma duração média de exposição de 25 semanas [ver Estudos clínicos ]. The mean age was 44.4 years e the mean duration of diabetes was 19.9 years. 59% were male 93% were White e 2% were Black or African American; e 7% were Hispanic or Latino. The mean BMI was 26.7 kg/m² e the mean HbA1c at baseline was 7.6%.
Os dados da Tabela 2 refletem a exposição de 341 pacientes adultos com diabetes mellitus tipo 2 a fiasp em um ensaio clínico com uma duração média de exposição de 24 semanas [ver Estudos clínicos ]. The mean age was 59.6 years e the mean duration of diabetes was 13.2 years. 47% were male 80% were White e 6% were Black or African American; e 8% were Hispanic or Latino. The mean BMI was 31.5 kg/m² e the mean HbA1c at baseline was 8.0%.
Os dados da Tabela 3 refletem a exposição de 519 pacientes pediátricos com diabetes mellitus tipo 1 a fiasp em um ensaio clínico com uma duração média de exposição de 26 semanas [veja Estudos clínicos ]. The mean age was 11.7 years e the mean duration of Diabetes mellitus was 4.4 years. 54% were male 81% were White 16% were Asian e 2% were Black or African American. The mean BMI was 19.7 kg/m² e the mean HbA1c at baseline was 7.6%.
Reações adversas comuns excluindo hipoglicemia foram definidas como eventos que ocorrem em ≥5% e ocorrendo na mesma taxa ou superior para pacientes tratados com FIASP do que pacientes tratados com comparador.
Tabela 1: reações adversas (%*) em pacientes adultos com diabetes mellitus tipo 1
| Mealtime FIASP Insulin detemir (N = 386) | Pós -meal fiasp insulina detemir (N = 377) | |
| Nasofaringite | 20.2 | 23.9 |
| Infecção do trato respiratório superior | 9.1 | 7.4 |
| Náusea | 4.9 | 5.0 |
| Diarréia | 5.4 | 3.2 |
| Dor nas costas | 5.2 | 4.0 |
| *Incidência ≥ 5% e ocorrendo na mesma taxa ou superior com fiasp do que o comparador |
Tabela 2: Reações adversas (%*) em pacientes adultos com diabetes mellitus tipo 2
| Fiasp insulina glargine (N = 341) | |
| Infecção do trato urinário | 5.9 |
| *Incidência ≥ 5% e ocorrendo na mesma taxa ou superior com fiasp do que o comparador |
Tabela 3: Reações adversas (%*) em pacientes pediátricos com diabetes mellitus tipo 1
| FIASP FIASP DESELHA DEGLUDEC (N = 261) | Pós -Meal Fiasp Insulin Degludec (N = 258) | |
| Infecção do trato respiratório superior viral | 23.0 | 20.5 |
| Infecção do trato respiratório superior | 8.4 | 12.4 |
| Gripe | 7.7 | 5.8 |
| Rinite | 3.8 | 6.2 |
| Dor de cabeça | 6.1 | 10.1 |
| Pirexia | 8.4 | 6.2 |
| Vomitando | 3.4 | 8.1 |
| *Incidência ≥ 5% e ocorrendo na mesma taxa ou superior com fiasp do que o comparador |
Hipoglicemia
Hipoglicemia is the most commonly observed adverse reaction in patients using insulin including FIASP. The rates of reported Hipoglicemia depend on the definition of Hipoglicemia used diabetes type insulin dose intensity of glucose control background therapies e other intrinsic e extrinsic patient factors. For these reasons comparing rates of Hipoglicemia in clinical trials for FIASP with the incidence of Hipoglicemia for other products may be misleading e also may not be representative of Hipoglicemia rates that occur in clinical practice.
As taxas de incidência para hipoglicemia grave em adultos com diabetes mellitus tipo 1 e tipo 2 e pacientes pediátricos com diabetes mellitus tipo 1 tratados com fiasp em ensaios clínicos são mostrados na Tabela 4 [ver Estudos clínicos ].
Tabela 4: Proporção (%) de pacientes com diabetes tipo 1 e diabetes mellitus tipo 2 experimentando pelo menos um episódio de hipoglicemia grave em ensaios clínicos adultos e pediátricos
| Estude A (tipo 1) adultos | Estudo B (tipo 2) Adultos | Estudo E (tipo 1) pediátrico | Estudo D (CSII tipo 1) | |||
| Mealtime FIASP Insulin detemir (N = 386) | Pós -meal fiasp insulina detemir (N = 377) | Fiasp insulina glargine (N = 341) | FIASP FIASP DESELHA DEGLUDEC (N = 261) | Pós -Meal Fiasp Insulin Degludec (N = 258) | FIASP (N = 236) | |
| Hipoglicemia grave* | 6.7 | 8.0 | 3.2 | 1.1 | 3.1 | 4.7 |
| *Hipoglicemia grave: um episódio que exige assistência de outra pessoa para administrar ativamente o glucagon de carboidratos ou outras ações de ressuscitação |
A hipoglicemia confirmada por glicose no sangue foi definida como uma glicose auto-medida calibrada ao plasma inferior a 56 mg/dL.
No Estudo D pacientes adultos com diabetes mellitus tipo 1 tratados com fiasp em uma bomba relataram uma taxa mais alta de glicose no sangue confirmou episódios hipoglicêmicos na primeira hora após uma refeição em comparação com os pacientes tratados com o Novolog [ver Ensaios clínicos ].
No estudo, pacientes pediátricos com diabetes mellitus tipo 1 tratados com a hora das refeições e a fiasp pós -malha relataram uma taxa mais alta de episódios hipoglicêmicos confirmados por glicose no sangue em comparação com pacientes tratados com novato; O desequilíbrio foi maior durante o período noturno [ver Use em populações específicas Ensaios clínicos ].
Reações alérgicas
Alergias generalizadas graves com risco de vida, incluindo anafilaxia reações generalizadas da pele, hipotensão e choque de broncoespasmo angioedema podem ocorrer com qualquer insulina, incluindo fiasp e pode ser fatal. No programa clínico, as reações generalizadas de hipersensibilidade (manifestadas por erupção cutânea generalizada e edema facial) foram relatadas em 0,4% dos pacientes adultos tratados com fiasp. As manifestações alérgicas da pele relatadas com FIASP em 1,7% dos pacientes adultos do programa clínico incluem urticária pruritária precipitada eczema e dermatite. No estudo D, foram relatadas reações alérgicas em 4,2% dos pacientes adultos com diabetes mellitus tipo 1 tratados com FIASP. No estudo, as reações alérgicas foram relatadas em 4% dos pacientes pediátricos com diabetes mellitus tipo 1 tratados com fiasp.
Lipodistrofia
A administração de insulina, incluindo Fiasp, resultou em lipo -hipertrofia (aumento ou espessamento do tecido) e lipoatrofia (depressão na pele). No programa clínico, o lipodistrofia foi relatado em 0,4% dos pacientes adultos e 2,1% dos pacientes pediátricos tratados com fiasp [ver Dosagem e administração ].
Reações do local de injeção/infusão
Assim como em outros pacientes com terapia de insulina, pode sofrer uma inflamação precipitada da inflamação por dor ou coceira no local da injeção ou infusão de fiasp. Essas reações geralmente resolvem em alguns dias a algumas semanas, mas em algumas ocasiões podem exigir descontinuação de fiasp. No local do programa clínico, ocorreram reações no local de injeção em 1,6% dos pacientes adultos tratados com fiasp. No estudo, pacientes adultos com diabetes mellitus tipo 1 tratados com fiasp relataram reações de 2,2% no local da injeção. No estudo D, as reações do local da infusão foram relatadas em 10,2% dos pacientes adultos com diabetes mellitus tipo 1 tratados com fiasp. No estudo E as reações do local da injeção foram relatadas em 4,2% de pacientes pediátricos com diabetes mellitus tipo 1 tratados com FIASP.
Ganho de peso
O ganho de peso pode ocorrer com terapia com insulina, incluindo fiasp e foi atribuído aos efeitos anabólicos da insulina e à diminuição da glucosuria. No estudo, pacientes adultos com diabetes mellitus tipo 1 tratados com fiasp ganharam uma média de 0,7 kg e, no estudo B, os pacientes adultos com diabetes mellitus tipo 2 tratados com fiasp ganharam uma média de 2,7 kg.
Edema periférico
A insulina, incluindo FIASP, pode causar retenção de sódio e edema, principalmente se o controle metabólico anterior for melhorado pela terapia intensificada da insulina. No programa clínico, o edema periférico ocorreu em 0,8% dos pacientes adultos tratados com fiasp.
Experiência de pós -mercado
As seguintes reações adversas adicionais foram identificadas durante o uso pós-aprovação da ASPART da insulina. Como essas reações são relatadas voluntariamente de uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal à exposição a medicamentos.
Ocorreu amiloidose cutânea localizada no local da injeção. A hiperglicemia foi relatada com injeções repetidas de insulina em áreas de amiloidose cutânea localizada; A hipoglicemia foi relatada com uma mudança repentina em um local de injeção não afetado.
Interações medicamentosas for Fiasp
A Tabela 5 inclui interações medicamentosas clinicamente significativas com FIASP.
Tabela 5: Interações medicamentosas clinicamente significativas com Fiasp
| Medicamentos que podem aumentar o risco de hipoglicemia | |
| Drogas: | Os agentes antidiabéticos inibidores da ACE inibe os agentes de bloqueio do receptor da angiotensina fibrata a disopiramida os inibidores de monoamina oxidase inibidores da pentoxifilina pramlintida salicilatos de somatostatina análogos (por exemplo, octreotídeos) e antibióticos de sulfonamida. |
| Intervenção: | Reduções de dose e aumento da frequência de monitoramento da glicose podem ser necessários quando o FIASP é co-administrado com esses medicamentos. |
| Medicamentos que podem diminuir o efeito de redução da glicose no sangue do FIASP | |
| Drogas: | Antipsicóticos atípicos (por exemplo, olanzapina e clozapina) corticosteróides Diuréticos da danazol Estrógenos glucagon isoniazida niacina contraceptivos orais fenotiazinas progestogênicas (por exemplo, inibidores de reto -resumo e somibutores somropinatomimetomiméticos (porrais e inibidores de resíduos somibutores somtropinatomimetomiméticos Hormônios da tireóide. |
| Intervenção: | Aumentos da dose e aumento da frequência de monitoramento da glicose podem ser necessários quando o FIASP é co-administrado com esses medicamentos. |
| Medicamentos que podem aumentar ou diminuir o efeito de redução da glicose no sangue do FIASP | |
| Drogas: | Clonidina e sais de clonidina e lítio. A pentamidina pode causar hipoglicemia que às vezes pode ser seguida pela hiperglicemia. |
| Intervenção: | O ajuste da dose e o aumento da frequência de monitoramento da glicose podem ser necessários quando o FIASP é co-administrado com esses medicamentos. |
| Drogas que podem contornar sinais e sintomas de hipoglicemia | |
| Drogas: | Betabloqueadores Clonidina Guanetidina e Reserpina. |
| Intervenção: | O aumento da frequência do monitoramento da glicose pode ser necessário quando o FIASP é co-administrado com esses medicamentos. |
Avisos para Fiasp
Incluído como parte do PRECAUÇÕES seção.
Precauções para fiasp
Nunca compartilhe um dispositivo de cartucho de penfill de caneta fiasp fiaxtouch ou cartucho de penfill entre pacientes
FIASP FlexTouch disposable pen PenFill cartridge e PenFill cartridge devices should never be shared between patients even if the needle is changed. Patients using FIASP vials should never share needles or syringes with another person. Sharing poses a risk for transmission of blood-borne pathogens.
Hiperglicemia ou hipoglicemia com mudanças no regime de insulina
Alterações em um regime de insulina (por exemplo, local de injeção do tipo de resistência à insulina ou método de administração) podem afetar o controle glicêmico e predispor a Hipoglicemia [ver Avisos e precauções ] ou hiperglicemia. Foram relatadas injeções repetidas de insulina em áreas de lipodistrofia ou amiloidose cutânea localizada resultar em hiperglicemia; e uma mudança repentina no local da injeção (para uma área não afetada) foi relatada para resultar em hipoglicemia [ver Reações adversas ].
Faça alterações no regime de insulina de um paciente sob supervisão médica estreita com maior frequência de monitoramento de glicose no sangue. Aconselhe os pacientes que injetaram repetidamente em áreas de lipodistrofia ou amiloidose cutânea localizada para alterar o local da injeção para áreas não afetadas e monitorar de perto a hipoglicemia. Para pacientes com tipo 2 Diabetes mellitus Podem ser necessários ajustes de dose no tratamento antidiabético concomitante.
Hipoglicemia
Hipoglicemia is the most common adverse reaction of all insulin therapies including FIASP [ver Reações adversas ]. Severe Hipoglicemia can cause seizures may lead to unconsciousness may be life-threatening or cause death. Hipoglicemia can impair concentration ability e reaction time; this may place an individual e others at risk in situations where these abilities are important (e.g. driving or operating other machinery). FIASP or any insulin should not be used during episodes of Hipoglicemia [ver Contra -indicações ].
Hipoglicemia can happen suddenly e symptoms may differ in each individual e change over time in the same individual. Symptomatic awareness of Hipoglicemia may be less pronounced in patients with longsteing diabetes in patients with diabetic nerve disease in patients using medications that block the sympathetic nervous system (e.g. Betabloqueadores) [ver Interações medicamentosas ou em pacientes que sofrem hipoglicemia recorrente.
Fatores de risco para hipoglicemia
O risco de hipoglicemia após uma injeção está relacionado à duração da ação da insulina e, em geral, é mais alta quando o efeito de redução da glicose da insulina é máximo. O momento da hipoglicemia geralmente reflete o perfil de ação no tempo da formulação de insulina administrada. Como em todas as preparações da insulina, o tempo de redução do efeito de glicose no tempo de fiasp pode variar em indivíduos diferentes ou em momentos diferentes no mesmo indivíduo e depende de muitas condições, incluindo a área de injeção, bem como o suprimento de sangue e a temperatura do local da injeção [consulte Use em populações específicas Farmacologia Clínica ].
Outros fatores que podem aumentar o risco de hipoglicemia incluem alterações no padrão de refeições (por exemplo, conteúdo de macronutrientes ou tempo das refeições) mudanças no nível de atividade física ou mudanças no medicamento co-administrado [consulte Interações medicamentosas ]. Patients with renal or hepatic impairment may be at higher risk of Hipoglicemia [ver Use em populações específicas ].
Estratégias de mitigação de risco para hipoglicemia
Pacientes e cuidadores devem ser educados para reconhecer e gerenciar a hipoglicemia. O auto-monitoramento da glicose no sangue desempenha um papel essencial na prevenção e gerenciamento da hipoglicemia. Em pacientes com maior risco de hipoglicemia e pacientes que reduziram a conscientização sintomática da hipoglicemia, recomenda -se a frequência do monitoramento de glicose no sangue.
Hipoglicemia Due To Medication Errors
Mixagens acidentais entre produtos de insulina foram relatadas. Para evitar erros de medicação entre o FIASP e outras insulinas, instrua os pacientes a sempre verificar o rótulo da insulina antes de cada injeção.
Hipocalemia
Todos os produtos de insulina, incluindo Fiasp, podem causar uma mudança no potássio do espaço extracelular para intracelular, possivelmente levando à hipocalemia. A hipocalemia não tratada pode causar arritmia ventricular e morte por paralisia respiratória. Monitore os níveis de potássio em pacientes em risco de hipocalemia, se indicado (por exemplo, pacientes que usam medicamentos que reduzem o potássio que tomam medicamentos sensíveis às concentrações de potássio).
Hipersensibilidade e reações alérgicas
Generalizada grave com risco de vida alergia incluindo anafilaxia pode ocorrer com produtos de insulina, incluindo fiasp [ver Reações adversas ]. If Hipersensibilidade reactions occur discontinue FIASP; treat per steard of care e monitor until symptoms e signs resolve. FIASP is contraindicated in patients who have had Hipersensibilidade reactions to insulina aspart or any of the excipients in FIASP [ver Contra -indicações ].
Retenção de fluidos e insuficiência cardíaca com uso concomitante de agonistas de PPAR-gama
Os tiazolidinediones (TZDs), que são o receptor ativado por proliferador de peroxissomo (agonistas do PPAR)-pode causar retenção de líquidos relacionados à dose, particularmente quando usado em combinação com a insulina. A retenção de fluidos pode levar ou exacerbar a insuficiência cardíaca. Pacientes tratados com insulina, incluindo fiasp e um agonista do PPAR-gama devem ser observados para sinais e sintomas de insuficiência cardíaca. Se a insuficiência cardíaca se desenvolver, deve ser gerenciada de acordo com os padrões atuais de atendimento e descontinuação ou redução da dose do agonista do PPAR-gama, deve ser considerada.
Hiperglicemia e cetoacidose devido a mau funcionamento do dispositivo da bomba de insulina
Os conjuntos de bombas de bomba ou infusão podem levar a um rápido início de hiperglicemia e cetoacidose. É necessária identificação e correção imediata da causa da hiperglicemia ou cetose. A terapia intermediária com injeção subcutânea de fiasp pode ser necessária. Pacientes que usam terapia contínua da bomba de infusão de insulina subcutânea devem ser treinados para administrar insulina por injeção e ter terapia alternativa à insulina disponível em caso de falha da bomba [ver Dosagem e administração Como fornecido / Armazenamento e manuseio e Informações de aconselhamento para pacientes ].
Informações de aconselhamento para pacientes
Aconselhe o paciente a ler a rotulagem de pacientes aprovados pela FDA ( Informação do paciente e instruções para uso ).
Nunca compartilhe um dispositivo de cartucho Penfill ou cartucho de caneta FIAXTOUCH Penfill entre os pacientes entre os pacientes
Aconselhe os pacientes que eles nunca devem compartilhar um cartucho de caneta Fiasp Flextouch Penfill ou dispositivos de cartucho de penfill com outra pessoa, mesmo que a agulha seja alterada, porque isso carrega um risco de transmissão de patógenos transmitidos pelo sangue. Aconselhe os pacientes que usam frascos fiasp para não compartilhar agulhas ou seringas com outra pessoa. Compartilhar representa um risco de transmissão de patógenos transmitidos pelo sangue [ver Avisos e precauções ].
Hiperglicemia ou hipoglicemia
Informe os pacientes que a hipoglicemia é a reação adversa mais comum com insulina. Instrua os pacientes sobre procedimentos de autogestão, incluindo a técnica de injeção adequada de glicose e o gerenciamento de hipoglicemia e hiperglicemia, especialmente no início da terapia FIASP. Instrua os pacientes sobre o manuseio de situações especiais, como condições intercurrentas (estresse por doença ou distúrbios emocionais) uma dose inadequada ou ignorada por uma administração inadvertida de um aumento da dose de insulina inadequada ingestão de alimentos e as refeições ignoradas. Instrua os pacientes sobre o tratamento da hipoglicemia [ver Avisos e precauções ].
Informe os pacientes que sua capacidade de se concentrar e reagir pode ser prejudicada como resultado da hipoglicemia. Aconselhe os pacientes com hipoglicemia frequente ou sinais de alerta reduzidos ou ausentes de hipoglicemia para usar cautela ao dirigir ou operar máquinas.
Aconselhe os pacientes que as alterações no regime de insulina podem predispor à hiperglicemia ou hipoglicemia e que as mudanças no regime de insulina devem ser feitas sob supervisão médica íntima [ver Avisos e precauções ].
Reações de hipersensibilidade
Aconselhe os pacientes que ocorreram reações de hipersensibilidade com fiasp. Informar os pacientes sobre os sintomas das reações de hipersensibilidade [ver Avisos e precauções ].
Hipoglicemia Due To Medication Errors
Instrua os pacientes a sempre verificar o rótulo de insulina antes de cada injeção para evitar confundir entre produtos de insulina.
Pacientes usando bombas de insulina subcutânea contínuas
- Treine pacientes em terapia intensiva de insulina com múltiplas injeções e na função de seus acessórios de bomba e bomba.
- Instrua os pacientes a seguir as recomendações dos prestadores de serviços de saúde ao definir a taxa de infusão basal e do tempo das refeições.
- Consulte o manual do usuário da bomba de infusão subcutânea contínua para ver se o FIASP pode ser usado com a bomba. Veja conjuntos de reservatórios e infusão recomendados no manual do usuário da Bomba de Insulina.
- Instrua os pacientes a mudar de fiasp no reservatório da bomba pelo menos a cada 6 dias ou a substituir o cartucho da bomba pelo menos a cada 4 dias ou ou de acordo com o manual do usuário da bomba, o que for mais curto; Os conjuntos de infusão e os locais de inserção do conjunto de infusão devem ser alterados de acordo com o manual do usuário dos fabricantes. Seguindo esse cronograma, os pacientes evitam a oclusão de infusão de degradação da insulina e perda do conservante de insulina.
- Instrua os pacientes a descartar a insulina exposta a temperaturas superiores a 37 ° C (98,6 ° F).
- Instrua os pacientes a informar o médico e selecionar um novo local para infusão se o local da infusão se tornar prurigitor eritematosa ou espessado.
- Instrua os pacientes sobre o risco de hiperglicemia rápida e cetose devido a um conjunto de infusão de mau funcionamento da bomba, desconexão de vazamento de oclusão ou torções e insulina degradada. Instrua os pacientes sobre o risco de hipoglicemia do mau funcionamento da bomba. Se esses problemas não puderem ser prontamente corrigidos, instrua os pacientes a retomar a terapia com injeção subcutânea de insulina e entrar em contato com seu médico [ver Avisos e precauções e Como fornecido / Armazenamento e manuseio ].
Toxicologia não clínica
Carcinogênese mutagênese comprometimento da fertilidade
Em 52 semanas, estudos Sprague-Dawley ratos foram dosados por subcutânea com insulina aspart em 10 50 e 200 unidades/kg/dia (aproximadamente 2 8 e 32 vezes a dose subcutânea humana de 1,0 unidades/kg/dia com base em unidades/área da superfície do corpo, respectivamente). Na dose de 200 unidades/kg/dia, a aspartamento de insulina aumentou a incidência de tumores da glândula mamária nas fêmeas quando comparada aos controles não tratados. A incidência de tumores mamários para a insulina aspart não foi significativamente diferente da insulina humana regular. A relevância dessas descobertas para os seres humanos não é conhecida.
ASPART de insulina não foi genotóxica nos seguintes testes: Ames Teste o linfoma de linfoma de camundongo Teste de mutação de genes para a frente Teste de aberração de linfocitários periféricos humanos Teste de aberração de micronúcleos in vivo em camundongos e no teste de UDs ex vivo em hepatocytes de rato.
Em estudos de fertilidade em ratos machos e fêmeas em doses subcutâneas de até 200 unidades/kg/dia (aproximadamente 32 vezes a dose subcutânea humana com base em unidades/área da superfície corporal) sem efeitos adversos diretos na fertilidade masculina e feminina ou no desempenho reprodutivo geral dos animais.
Use em populações específicas
Gravidez
Resumo do risco
Não há dados disponíveis com fiasp em mulheres grávidas para informar um risco associado a drogas para grandes defeitos congênitos e aborto. Informações disponíveis de ensaios controlados randomizados publicados com uso de insulina aspart durante o segundo trimestre da gravidez não relataram uma associação com a insulina aspart e os principais defeitos congênitos ou os resultados maternos ou fetais adversos [ver [ver Dados ]. There are risks to the mother e fetus associated with poorly controlled diabetes in pregnancy [ver Considerações clínicas ].
Nos estudos de reprodução de animais, a administração de asparas subcutâneas de insulina a ratos e coelhos grávidas durante o período de organogênese não causou efeitos adversos ao desenvolvimento em exposições 8 vezes e igual à dose subcutânea humana de 1,0 unidade/kg/dia, respectivamente. Perdas pré e pós-implantação e anormalidades viscerais/esqueléticas foram observadas em exposições mais altas que são consideradas secundárias à hipoglicemia materna. Esses efeitos foram semelhantes aos observados em ratos administrados pela insulina humana regular [ver Dados ].
O risco de fundo estimado dos principais defeitos congênitos é de 6 a 10% em mulheres com diabetes pré-gestacional com HbA1c> 7% e foi relatado como de 20 a 25% em mulheres com HbA1c> 10%. O risco de fundo estimado de aborto para a população indicada é desconhecido. Na população geral dos EUA, o risco estimado de antecedentes de defeitos congênitos e aborto nas gestações clinicamente reconhecidas é de 2-4% e 15-20%, respectivamente.
Considerações clínicas
Risco materno e/ou embrionário associado à doença
O diabetes mal controlado na gravidez aumenta o risco materno de cetoacidose diabética pré -eclâmpsia abortos espontâneos complicações prematuras e entrega. O diabetes mal controlado aumenta o risco fetal para os principais defeitos congênitos e a morbidade relacionada à macrossomia.
Dados
Dados humanos
Os dados publicados de 5 ensaios clínicos randomizados de 441 mulheres grávidas com diabetes mellitus tratadas com insulina aspart, começando durante o final do segundo trimestre da gravidez, não identificaram uma associação de insulina asparte com grandes defeitos congênitos ou resultados maternos ou fetais adversos. No entanto, esses estudos não podem definitivamente estabelecer a ausência de qualquer risco devido a limitações metodológicas, incluindo uma duração variável do tratamento e pequeno tamanho da maioria dos ensaios.
Dados de animais
Estudos de embrionário-fetal e pré-natal de fertilidade foram realizados com insulina asparte e insulina humana regular em ratos e coelhos. Em um estudo combinado de fertilidade e desenvolvimento de embrio-fetal em ratos, a insulina aspart foi administrada antes do acasalamento durante o acasalamento e durante a gravidez. Além disso, em um estudo de desenvolvimento pré e pós-natal, a insulina aspart foi dada durante toda a gravidez e durante a lactação a ratos. Em um estudo de desenvolvimento embrionário, a insulina asparte foi dada a coelhos do sexo feminino durante a organogênese. Os efeitos da insulina aspart não diferiram daqueles observados com insulina humana regular subcutânea. Insulina asparte como insulina humana causou perdas pré e pós-implantação e anormalidades viscerais/esqueléticas em ratos na dose de 200 unidades/kg/dia (aproximadamente 32 vezes a dose subcutânea humana de 10 unidades/kg/dia de exposição humana/mais ou mais de um dia de exposição humana) e em reposição a mais de uma unidade de 10 unidades de 10 unidades/kg de reposição/dia de exposição humana) e em reposição a mais de uma unidade de 10 unidades em que a unidade de 42 anos de exposição/dia de exposição humana) e em reposição de 10 anos e mais ou menos de uma dose de 42 e mais ou menos de uma dose de 42 e mais ou menos de um dia de exposição. 1.0 unidade/kg/dia com base nos equivalentes de exposição humana). Não foram observados efeitos significativos em ratos na dose de 50 unidades/kg/dia e em coelhos na dose de 3 unidades/kg/dia. Essas doses são aproximadamente 8 vezes a dose subcutânea humana de 1,0 unidade/kg/dia para ratos e igual à dose subcutânea humana de 1,0 unidade/kg/dia para coelhos com base nos equivalentes de exposição humana. Os efeitos são considerados secundários à hipoglicemia materna.
Lactação
Resumo do risco
Não há dados sobre a presença de fiasp no leite humano os efeitos no bebê amamentado ou no efeito na produção de leite. Um pequeno estudo publicado relatou que a insulina exógena, incluindo a insulina Aspart, estava presente no leite humano. No entanto, não há informações insuficientes para determinar os efeitos da aspartamento de insulina no bebê amamentado e nenhuma informação disponível sobre os efeitos da insulina asparte na produção de leite. Os benefícios de desenvolvimento e saúde da amamentação devem ser considerados juntamente com a necessidade clínica da mãe de insulina quaisquer efeitos adversos potenciais na criança amamentada de fiasp ou insulina aspart ou da condição materna subjacente.
Uso pediátrico
A segurança e a eficácia do FIASP foram estabelecidas para melhorar o controle glicêmico em pacientes pediátricos com diabetes mellitus. O uso de fiasp para esta indicação é apoiado por evidências de um estudo adequado e bem controlado em 777 pacientes pediátricos com diabetes mellitus tipo 1 com idades entre 2 e 17 anos e de estudos em adultos com diabetes mellitus [ver [ver veja Farmacologia Clínica e Estudos clínicos ].
Pacientes pediátricos com diabetes mellitus tipo 1 tratados com a hora das refeições e a fiasp pós -malha relataram uma taxa mais alta de episódios hipoglicêmicos confirmados por glicose no sangue em comparação com os pacientes tratados com novato; O desequilíbrio foi maior durante o período noturno. Monitore os níveis de glicose no sangue de perto em pacientes pediátricos [ver Avisos e precauções Experiência em ensaios clínicos ].
Uso geriátrico
Nos três estudos clínicos controlados 192 de 1219 (16%) pacientes tratados com fiasp com tipo 1 ou Diabetes tipo 2 As mellitus tinham ≥ 65 anos de idade e 24 de 1219 (2%) tinham ≥ 75 anos de idade. Não foram observadas diferenças gerais de segurança ou eficácia entre esses pacientes idosos e pacientes adultos mais jovens.
No entanto, deve -se ter cautela quando o FIASP for administrado a pacientes geriátricos. Em pacientes idosos com diabetes, os incrementos iniciais da dose de dose e a dosagem de manutenção devem ser conservadores para evitar hipoglicemia [ver Avisos e precauções Reações adversas e Estudos clínicos ].
Estudo farmacocinético/farmacodinâmico para avaliar o efeito da idade no início da ação FIASP foi realizado [ver Farmacologia Clínica ].
Comprometimento renal
Pacientes com comprometimento renal podem estar em risco aumentado de hipoglicemia e podem exigir um ajuste de dose de fiasp mais frequentes e monitoramento mais frequente de glicose no sangue [ver Avisos e precauções e Farmacologia Clínica ].
Comprometimento hepático
Pacientes com comprometimento hepático podem estar em risco aumentado de hipoglicemia e podem exigir um ajuste de dose de fiasp mais frequente e monitoramento mais frequente de glicose no sangue [ver Avisos e precauções e Farmacologia Clínica ].
Overdose Informações para Fiasp
O excesso de administração de insulina pode causar hipoglicemia e hipocalemia [ver Avisos e precauções ]. Mild episodes of Hipoglicemia usually can be treated with oral glucose. Adjustments in drug dosage meal patterns or exercise may be needed. More severe episodes with coma seizure or neurologic impairment may be treated with an intramuscular/subcutaneous Glucagon product for emergency use or concentrated intravenous glucose. Sustained carbohydrate intake e observation may be necessary because Hipoglicemia may recur after apparent clinical recovery. Hipocalemia must be corrected appropriately.
Contra -indicações para Fiasp
FIASP is contraindicated:
- Durante os episódios de hipoglicemia [ver Avisos e precauções ].
- Em pacientes com hipersensibilidade conhecida para insulina aspart ou qualquer um dos excipientes em fiasp [ver Avisos e precauções ].
Farmacologia Clínica for Fiasp
Mecanismo de ação
A atividade primária do FIASP é a regulação do metabolismo da glicose. Insulinas, incluindo insulina, asparam o ingrediente ativo no Fiasp, exercem sua ação específica através da ligação aos receptores de insulina. A insulina ligada ao receptor reduz a glicose no sangue, facilitando a captação celular de glicose no músculo esquelético e no tecido adiposo e inibindo a produção da glicose do fígado. A insulina inibe a lipólise no adipócito inibe a proteólise e aumenta a síntese de proteínas.
Farmacodinâmica
O curso do tempo da ação da insulina (isto é, a redução da glicose) pode variar consideravelmente em diferentes indivíduos ou dentro do mesmo indivíduo. O perfil farmacodinâmico médio (isto é, efeito de redução da glicose medido como taxa de infusão de glicose (GIR) em um estudo de pinça euglicêmico) para administração subcutânea de 0,1 0,2 e 0,4 unidade/kg de fiasp em 46 pacientes com diabetes tipo 1 Mellitus é mostrado na Figura 2 e a característica -chave do momento do momento dos efeitos no efeito.
Tabela 6: Tempo do efeito da insulina (isto é, efeito farmacodinâmico médio) após a administração subcutânea de 0,1 0,2 e 0,4 unidade/kg de fiasp em pacientes (n = 46) com diabetes mellitus tipo 1 e correspondente aos dados mostrados na Figura 2
| Parâmetro para efeito de insulina | FIASP 0.1 unit/kg | FIASP 0.2 unit/kg | FIASP 0.4 unit/kg |
| Tempo para o primeiro efeito mensurável | ~ 20 minutos | ~ 17 minutos | ~ 16 minutos |
| Hora de pico de efeito | ~ 91 minutos | ~ 122 minutos | ~ 133 minutos |
| ID de referência: 5194560 | |||
| Hora de efeito retornar à linha de base | ~ 5 horas | ~ 6 horas | ~ 7 horas |
Figura 2: Efeito médio da insulina (isto é, efeito farmacodinâmico médio) ao longo do tempo após a administração subcutânea de 0,1 0,2 e 0,4 unidade/kg de fiasp em pacientes (n = 46) com diabetes mellitus tipo 1
 |
Em média, os efeitos farmacodinâmicos do FIASP medidos como área sob a curva no tempo de taxa de infusão de glicose (AUCGIR) foram de 697 mg/kg 1406 mg/kg e 2427 mg/kg após a administração de 0,1 0,2 e 0,4 unidade/kg de fiasp.
A variabilidade do dia-a-dia no efeito de redução de glicose do FIASP nos pacientes foi de ~ 18% para a redução total da glicose (Aucgir 0-12h) e ~ 19% para o efeito máximo de redução da glicose (GIRMAX).
pílula com M357 de um lado
Farmacocinética
Absorção
Resultados farmacocinéticos de um estudo da pinça euglicêmica em pacientes adultos com diabetes mellitus tipo 1 (n = 51) mostraram que a insulina aspart apareceu na circulação ~ 2,5 minutos após a administração da FIASP Figura 3). O tempo para as concentrações máximas de insulina foi alcançado ~ 63 minutos após a administração de fiasp.
Figura 3: Perfil médio de concentração sérica de insulina asparte em indivíduos adultos com diabetes mellitus tipo 1 (n = 51) após uma única dose de 0,2 unidade/kg (subcutânea) de fiasp
 |
A exposição total à insulina e a concentração máxima de insulina aumentam proporcionalmente com o aumento da dose subcutânea de fiasp na faixa de dose terapêutica.
Distribuição
A insulina aspart tem uma baixa afinidade de ligação às proteínas plasmáticas (<10%) similar to that seen with regular human insulin.
Eliminação
A aparente meia-vida terminal após a administração subcutânea de fiasp é de cerca de 1,1 horas.
Populações específicas
O IMC e a raça de idade de idade não afetaram significativamente a farmacocinética e a farmacodinâmica do fiasp.
Pacientes com comprometimento renal e hepático
Com base em estudos conduzidos com insulina aspart renal e o comprometimento hepático, não se sabe que afeta a farmacocinética da aspartamento de insulina.
Imunogenicidade
A incidência observada de anticorpos antidrogas é altamente dependente da sensibilidade e especificidade do ensaio. As diferenças nos métodos de ensaio impedem comparações significativas da incidência de anticorpos antidrogas nos estudos descritos abaixo com a incidência de anticorpos antidrogas em outros estudos, incluindo os de fiasp ou outros produtos de insulina aspart.
Em um estudo de 26 semanas em indivíduos adultos com diabetes mellitus tipo 1 (Estudo A) [ver Estudos clínicos ] entre os 763 indivíduos que receberam FIASP 97% foram positivos para anticorpos anti-insulina reagindo (AIA) pelo menos uma vez durante o estudo, incluindo 90% positivos na linha de base. Um total de 25% dos pacientes que receberam fiasp foram positivos para anticorpos antidrogas (insulina aspart) (ADA) pelo menos uma vez durante o estudo, incluindo 17% positivos na linha de base.
Em um estudo de 26 semanas em indivíduos pediátricos com diabetes mellitus tipo 1 (Estudo e) [ver Estudos clínicos ] entre os 519 indivíduos que receberam FIASP 97% foram positivos para a AIA reagindo pelo menos uma vez durante o estudo, incluindo 95% positivos na linha de base. Um total de 19% dos pacientes que receberam fiasp foram positivos para a ADA pelo menos uma vez durante o estudo, incluindo 16,0% positivos na linha de base.
Não houve efeito clinicamente significativo identificado da ADA na segurança farmacodinâmica da farmacocinética ou eficácia do FIASP.
Estudos clínicos
Visão geral dos estudos clínicos
A eficácia do FIASP foi avaliada em 3 ensaios clínicos randomizados de 18 a 26 semanas em adultos e um estudo randomizado de tratamento para alvo de 26 semanas de duração pediátrica.
No total, 1224 indivíduos adultos (n = 763 com diabetes mellitus tipo 1; n = 461 com diabetes mellitus tipo 2) e 519 indivíduos pediátricos com diabetes mellitus tipo 1 foram randomizados para fiasp. Em pacientes adultos e pediátricos com diabetes mellitus fiasp do tipo 1 e fiasp pós-malha, levou ao controle glicêmico não inferior em comparação em comparação com a Novolog, ambos em combinação com insulina basal. Em pacientes adultos com diabetes mellitus tipo 2, o fiasp da hora da hora forneceu controle glicêmico não inferior em comparação com o Novolog, ambos em combinação com metformina. Além disso, a fiasp da hora das refeições em um regime basal-colus com metformina também proporcionou melhora estatisticamente significativa no controle glicêmico geral em comparação com a terapia basal de insulina sozinha com metformina em pacientes adultos com diabetes mellitus tipo 2.
Em adultos com diabetes mellitus tipo 1 (n = 472), o Fiasp levou ao controle glicêmico não inferior em comparação com o Novolog quando ambos foram administrados por bomba subcutânea de infusão de insulina (CSII) contínua.
Diabetes mellitus tipo 1
Estudo A (NCT01831765)
FIASP added to insulin detemir in adult patients with Type 1 Diabetes Mellitus inadequately controlled at baseline.
A eficácia do FIASP foi avaliada em um estudo multicêntrico controlado ativo de 26 semanas de 26 semanas em 1143 pacientes adultos com diabetes mellitus tipo 1 controlados inadequadamente controlados na linha de base. Os pacientes foram randomizados para fiasp da hora das refeições cegadas (n = 381) Novolog na hora das refeições (n = 380) ou fiasp pós-paralisamento aberto (n = 382), tudo em combinação com uma ou duas vezes por dia insulina detemir. Os pacientes de randomização foram transferidos para fiasp em uma unidade para unidade. Fiasp ou Novolog foi injetado de 0 a 2 minutos antes da refeição e o fiasp pós-meala foi injetado 20 minutos após o início da refeição.
A idade média dos indivíduos randomizados foi de 44,4 anos e a duração média do diabetes foi de 19,9 anos. 59% eram do sexo masculino 93% eram brancos e 2% eram negros ou afro -americanos; e 7% eram hispânicos ou latinos. O IMC médio foi de 26,7 kg/m².
Após 26 semanas de diferença de tratamento de tratamento na redução da HbA1c da linha de base entre as refeições em comparação com a Novolog e a diferença de tratamento entre fiasp pós-meala em comparação com a Novolog na hora das refeições, atendeu à margem não-especificada da não-inferioridade (0,4%). Ver Tabela 7. As doses de insulina foram semelhantes entre os braços do estudo na linha de base e no final do estudo.
Tabela 7: Resultados do Estudo A: Estudo de 26 semanas de fiasp da hora das refeições e fiasp pós-mela
| Mealtime FIASP insulin detemir | Pós -meal fiasp insulina detemir | Mealtime NovoLog insulin detemir | |
| Número de indivíduos randomizados (n) | 381 | 382 | 380 |
| HbA1c (%) | |||
| Linha de base (média) | 7.6 | 7.6 | 7.6 |
| Mudança média ajustada da linha de base | -0.32 | -0.13 | -0.17 |
| Diferença estimada do tratamento vs. Novolog [95% IC]* | -0.15 [-0,23; -0,07] | 0.04 [-0,04; 0.12] | |
| A linha de base é baseada na média dos últimos valores observados disponíveis antes da randomização. *Testado quanto à diferença de tratamento estimado por não inferioridade foi calculado usando modelo misto para medições repetidas (MMRM). 7,6% dos indivíduos no braço fiasp da hora das refeições 7,6% dos indivíduos no braço fiasp pós -farinha e 5,3% dos indivíduos no braço Novolog da hora das refeições estavam ausentes da avaliação final do HBA1C. |
Pacientes com diabetes mellitus tipo 1
Estudo E (NCT02670915) Fiasp adicionado à insulina degludec em pacientes pediátricos com diabetes mellitus tipo 1
A eficácia do FIASP foi avaliada em um estudo paralelo de 26 semanas de grupo paralelo de 3 braços controlados com 3 braços em 777 pacientes pediátricos com diabetes mellitus tipo 1. Os pacientes foram randomizados para fiasp da hora das refeições cegas (n = 260) Novolog na hora das refeições (n = 258) ou fiasp pós-paralisamento aberto (n = 259), tudo em combinação com insulina degludec uma vez por dia. Fiasp ou Novolog foi injetado de 0 a 2 minutos antes da refeição e o fiasp pós-meala foi injetado 20 minutos após o início da refeição.
A idade média dos sujeitos na linha de base foi de 11,7 anos (intervalo de 2 a 17 anos) e a duração média do diabetes foi de 4,4 anos. 54% eram do sexo masculino, 81% eram brancos 16% eram asiáticos e 2% eram negros ou afro -americanos. O IMC médio foi de 19,7 kg/m².
Após 26 semanas de tratamento, a diferença de tratamento para alteração na HbA1c da linha de base entre as refeições em comparação com o Novolog da hora das refeições e a diferença de tratamento entre fiasp pós-meala em comparação com a Novolog na hora das refeições atendeu à margem não-especialidade pré-especificada (0,4%). Consulte a Tabela 8. As doses de insulina foram semelhantes entre os braços do estudo na linha de base e no final do estudo.
Tabela 8: Resultados do Estudo E: Estudo de 26 semanas de fiasp da hora das refeições e fiasp pós-mela
| FIASP FIASP DESELHA DEGLUDEC | Pós -Meal Fiasp Insulin Degludec | As refeições Novologa Insulin Degludec | |
| Número de indivíduos randomizados (n) | 260 | 259 | 258 |
| HbA1c (%) | |||
| Linha de base (média) | 7.57 | 7.58 | 7.53 |
| Mudança média ajustada da linha de base | 0.06 | 0.35 | 0.22 |
| Diferença estimada do tratamento vs. Novolog [95% IC]* | -0.17 [-0,30; -0,03] | 0.13 [-0,01; 0,26] | |
| A linha de base é baseada na média dos últimos valores observados disponíveis antes da randomização. *Testado quanto à não inferioridade A diferença estimada do tratamento foi calculada usando ANCOVA. A mudança da semana 26 na HbA1c estava ausente por 1,5% 1,9% e 1,6% dos indivíduos no FIASP FIASP FIASP e NOVOLOL, respectivamente. Os valores ausentes foram imputados com uma falta de suposição aleatória. |
Diabetes mellitus-adults tipo 2
Estudo B (NCT01819129): Fiasp adicionado à insulina basal e antidiabéticos orais em pacientes com diabetes mellitus tipo 2 inadequadamente controlados na linha de base na insulina basal e antidiabética oral
A eficácia do FIASP foi avaliada em um estudo de grupo paralelo multicenter controlado a segmentar de 26 semanas e segmentar, em 689 pacientes adultos com diabetes mellitus tipo 2, que foram controlados inadequadamente em linha basal em menos 6 meses. Os pacientes foram randomizados para fiasp na hora das refeições ou para o Novolog, na hora das refeições, tanto em combinação com a insulina e a metformina em um regime basal-colus. Fiasp da hora das refeições ou Novolog na hora das refeições foi injetado 0-2 minutos antes da refeição.
A idade média dos indivíduos randomizados foi de 59,5 anos e a duração média do diabetes foi de 12,7 anos. 49% eram do sexo masculino 81% eram brancos e 6% eram negros ou afro -americanos; e 6% eram hispânicos ou latinos. O IMC médio era de 31,2 kg/m².
Após 26 semanas de tratamento, a diferença de tratamento na redução da HbA1c da linha de base entre as refeições fiasp e a Novolog, na hora das refeições, tanto em combinação com a insulina Glargine quanto a metformina, atendeu à margem não-especificada da não-inferioridade (0,4%). Ver Tabela 9. As doses de insulina foram semelhantes entre os braços de estudo no final do estudo.
Tabela 9: Resultados do Estudo B: Estudo de 26 semanas de fiasp da hora das refeições em comparação com o Novolog, ambos usados em combinação com insulina glargina e metformina em adultos com diabetes mellitus tipo 2
| FIASP FIASP FIASP METFORMINA GLARGINA | Refeição Novolog Insulin Glargine Metformin | |
| Número de indivíduos randomizados (n) | 345 | 344 |
| HbA1c (%) | ||
| Linha de base | 8.0 | 7.9 |
| Mudança ajustada da linha de base | -1.38 | -1.36 |
| Diferença estimada do tratamento vs. Novolog [95%IC]* | -0.02 [-0,15; 0.10] | |
| A linha de base é baseada na média dos últimos valores observados disponíveis antes da randomização. *Testado quanto à não inferioridade Estimated treatment difference was calculated using mixed model for repeated measurements (MMRM). 11.9% of subjects on the Mealtime FIASP arm e 10.2% of subjects on the Mealtime Novolog arm were missing the final HbA1c assessment. |
Estudo C (NCT01850615): Fiasp adicionado à insulina basal e metformina em pacientes com diabetes mellitus tipo 2 controlados inadequadamente na linha de base na insulina basal e na metformina
A eficácia do FIASP foi avaliada em um estudo randomizado de grupo paralelo aberto de 18 semanas em 236 pacientes adultos com diabetes mellitus tipo 2 que foram controlados inadequadamente em terapia basal de insulina e metformina, com ou sem outra terapia antidiabética oral por pelo menos 3 meses. Os pacientes foram randomizados para fiasp na hora das refeições, além da insulina basal e da metformina ou à continuação da insulina basal e terapia com metformina sem fiasp. As insulinas basais usadas em ambos os braços de tratamento foram insulina insulina de insulina ou NPH. Todos os pacientes também foram necessários para estar em tratamento com metformina ≥1000 mg na linha de base.
A idade média da população do teste foi de 57,4 anos e a duração média do diabetes foi de 11.; anos. 48% eram do sexo masculino 70% eram brancos e 4% eram negros ou afro -americanos; e 37% eram hispânicos ou latinos. O IMC médio foi de 30,8 kg/m².
Após 18 semanas de adição de tratamento de fiasp à insulina basal e metformina estatisticamente, reduziu significativamente a HbA1c em comparação com a continuação da insulina basal e a terapia com metformina sem adição de FIASP (Tabela 10).
Tabela 10: Resultados do Estudo C: Estudo de 18 semanas de fiasp da hora das refeições em adultos com diabetes mellitus tipo 2 controlados inadequadamente na linha de base na insulina basal e na metformina
| FIASP + basal insulin + metformin | Metformina de insulina basal | |
| Número de indivíduos randomizados (n) | 116 | 120 |
| HbA1c (%) | ||
| Linha de base | 7.9 | 7.9 |
| Mudança ajustada da linha de base | -1.16 | -0.22 |
| Diferença estimada do tratamento vs. metformina de insulina basal [IC 95%] | -0.94 [-1.17; -0,72]* | |
| Proporção de pacientes que atingem o HBATC <7% at Trial End | 60,3% | 18,3% |
| A linha de base é baseada na média dos últimos valores observados disponíveis antes da randomização. *p<0.0001 1-sided p-value evaluated at 2.5% level for superiority. A diferença estimada do tratamento foi calculada usando modelo misto para medições repetidas (MMRM). 6,0% dos indivíduos no braço fiasp da hora das refeições e 3,3% dos indivíduos no braço placebo estavam ausentes da avaliação final do HbA1c. |
Diabetes mellitus tipo 1
Estudo D (NCT02825251): Fiasp em infusão de insulina subcutânea contínua (CSII) em adultos com diabetes mellitus tipo 1
A eficácia e a segurança do FIASP vs. Novolog em CSII em indivíduos adultos com diabetes mellitus tipo 1 (n = 472) foi avaliado em um estudo de grupo paralelo controlado a segimento multicêntrico e multicêntrico, com um período de tratamento de 4 semanas e um período de tratamento de 16 semanas. A infusão de insulina em bolus no tempo de refeição foi iniciada por 0 a 2 minutos antes de uma refeição.
A idade média dos indivíduos randomizados foi de 43 anos e a duração média do diabetes foi de 24 anos. 43% eram do sexo masculino. 89% eram brancos 1% eram negros ou afro -americanos e 1% eram asiáticos; e 3% eram hispânicos ou latinos. O IMC médio foi de 26,3 kg/m².
Após 16 semanas de tratamento, a diferença de tratamento na redução de HbA1c da linha de base entre Fiasp e Novolog foi de 0,10 com IC 95%[0,02 0,18] (Tabela 11).
Tabela 11: Resultados do Estudo D: Fiasp de 16 semanas em adultos com diabetes tipo 1
| FIASP | Novolog | |
| Número de indivíduos randomizados (n) | 236 | 236 |
| HbA1c (%) | ||
| Linha de base | 7.5 | 7.5 |
| Mudança ajustada da linha de base | -0.04 | -0.14 |
| Diferença estimada de tratamento Fiasp vs. Novolog [IC 95%]* | 0,10 [0,02; 0.18] | |
| Proporção de pacientes que alcançam HbA1c <7% at Trial End | 20,3% | 23,3% |
| A linha de base é baseada na média dos últimos valores observados disponíveis antes da randomização. *Testado quanto à não inferioridade using a margin of 0.4%. A diferença estimada do tratamento foi calculada usando ANCOVA. 2,1% dos indivíduos no braço fiasp e 2,5% dos indivíduos no braço do Novolog estavam ausentes da avaliação final do HbA1C. Os valores ausentes foram imputados usando imputação múltipla com uma média igual ao valor da linha de base do paciente correspondente. |
Informações do paciente para fiasp
FIASP®
(taxa-asp)
(insulina aspart) injeção para uso subcutâneo ou intravenoso
Não compartilhe seu fiasp com outras pessoas, mesmo que a agulha tenha sido alterada. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
O que é fiasp?
- FIASP is a man-made insulin that is used to control Alto açúcar no sangue in adults e children with Diabetes mellitus.
Quem não deve levar fiasp?
Não tome fiasp se você:
- estão tendo um episódio de baixo açúcar no sangue (hipoglicemia).
- Tenha alergia à insulina aspart ou qualquer um dos ingredientes em fiasp.
Antes de tomar o FIASP, informe ao seu provedor de saúde sobre todas as suas condições médicas, incluindo se você:
- tem problemas renais.
- ter problemas hepáticos.
- estão grávidas ou planejam engravidar. Converse com seu médico sobre a melhor maneira de controlar o açúcar no sangue se você planeja engravidar ou enquanto estiver grávida.
- estão amamentando ou planejam amamentar. Não se sabe se Fiasp passa para o seu leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê enquanto usa o FIASP.
- estão tomando novas receita médica ou medicamentos sem receita, vitaminas ou suplementos de ervas. Antes de começar a levar o Fiasp, converse com seu médico sobre baixo teor de açúcar no sangue e como gerenciá -lo.
Como devo levar fiasp?
- Leia as instruções para uso Isso vem com seu fiasp.
- Faça FIAsp exatamente como seu provedor de assistência médica diz para você.
- FIASP starts acting fast. Você deve tomar a dose de fiasp no início da refeição ou dentro de 20 minutos após o início de uma refeição.
- Conheça o tipo e a força da insulina que você toma. Não altere o tipo de insulina que você toma, a menos que seu médico dissesse. A quantidade de insulina e o melhor momento para você tomar sua insulina podem precisar alterar se você tomar diferentes tipos de insulina.
- Se você perder uma dose de fiasp, monitore seus níveis de açúcar no sangue para decidir se é necessária uma dose de insulina. Continue com sua programação regular de dosagem na próxima refeição.
- Verifique seus níveis de açúcar no sangue. Pergunte ao seu prestador de serviços de saúde qual deve ser seus açúcares no sangue e quando você deve verificar seus níveis de açúcar no sangue.
- Não reutilize ou compartilhe agulhas com outras pessoas. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
- FIASP can be injected under the skin (subcutaneously) of your stomach area upper legs or upper arms or by continuous infusion under the skin (subcutaneously) through an insulin pump into an area of your body recommended in the instructions that come with your insulin pump.
- Altere (gire) seus locais de injeção dentro da área que você escolher com cada dose Para reduzir o risco de obter poços na pele ou na pele espessada (lipodistrofia) e na pele com pedaços (amiloidose cutânea localizada) nos locais de injeção.
- Não Use exatamente o mesmo local para cada injeção.
- Não Injetar onde a pele tem poços está espessada ou tem nódulos.
- Não Injete onde a pele está machucada tenra escamosa ou dura ou em cicatrizes ou pele danificada.
O que devo evitar ao tomar fiasp?
Enquanto toma fiasp não:
- Dirija ou opere máquinas pesadas até saber como o Fiasp afeta você.
- Beba álcool ou use medicamentos prescritos ou vendidos sem receita que contêm álcool.
Quais são os possíveis efeitos colaterais do fiasp?
FIASP may cause serious side effects that can lead to death including:
- baixo açúcar no sangue (Hipoglicemia). Os sinais e sintomas que podem indicar baixo açúcar no sangue incluem:
- tontura or light-headedness
- visão turva
- ansiedade irritability or mood changes
- suando
- discurso arrastado
- fome
- confusão
- Shakakess
- dor de cabeça
- batida de coração rápido
- baixo potássio no seu sangue (hipocalemia).
- reações alérgicas graves (reações corporais inteiras). Obtenha ajuda médica de emergência imediatamente se tiver algum desses sinais ou sintomas de uma reação alérgica grave:
- Uma erupção cutânea sobre todo o seu corpo, problema, respirar um inchaço rápido da língua do rosto ou da garganta suando a confusão de sonolência extrema.
- insuficiência cardíaca. Tomar certos pílulas para diabetes chamadas TZDs (tiazolidinedionas) com fiasp pode causar insuficiência cardíaca em algumas pessoas. Isso pode acontecer mesmo se você nunca teve insuficiência cardíaca ou problemas cardíacos antes. Se você já tem insuficiência cardíaca, pode piorar enquanto toma TZDs com Fiasp. Seu médico deve monitorá -lo de perto enquanto você está tomando TZDs com Fiasp. Diga ao seu médico se você tiver algum sintoma novo ou pior de insuficiência cardíaca, incluindo falta de inchaço dos tornozelos ou pés repentinos de peso. O tratamento com TZDs e FIASP pode precisar ser ajustado ou interrompido pelo seu médico se você tiver insuficiência cardíaca nova ou pior.
Sua dose de insulina pode precisar mudar por causa de:
- Mudança no nível de atividade física ou exercício
- aumento do estresse
- Mudança na dieta
- ganho de peso or loss
- doença
Os efeitos colaterais comuns do fiasp podem incluir:
- Problemas de pele, como eczema erupção cutânea com coceira e inchaço da sua pele (dermatite)
- reações no local da injeção, como coceira, erupção cutânea
- espessamento da pele ou poços no local da injeção (lipodistrofia)
- ganho de peso
Esses não são todos os possíveis efeitos colaterais do FIASP. Ligue para o seu médico para obter conselhos médicos sobre efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Informações gerais sobre o uso seguro e eficaz do fiasp.
Às vezes, os medicamentos são prescritos para outros fins que não os listados em um folheto de informações do paciente. Você pode solicitar ao seu farmacêutico ou prestador de serviços de saúde informações sobre fiasp que estão escritas para profissionais de saúde. Não use fiasp para uma condição para a qual não foi prescrita. Não dê fiasp a outras pessoas, mesmo que elas tenham os mesmos sintomas que você tem. Isso pode prejudicá -los.
Quais são os ingredientes em fiasp?
Ingrediente ativo: insulina aspart
Ingredientes inativos: fosfato de sódio dibásico arginina glicerina metacresol niacinamida fenol zinco e água para injeção.
Instruções para uso
FIASP®
[Taxa 'ASP] FLEXTOUCH® (insulina aspart) Injeção para uso subcutâneo de 3 mL de caneta de uso único: 100 unidades/ml (U-100)
- Não Compartilhe sua caneta Fiasp Flextouch com outras pessoas, mesmo que a agulha seja alterada. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
- FIASP FlexTouch Pen (Pen) is a prefilled disposable single-patientÂuse pen contendo 300 unidades de injeção de fiasp U-100 (insulina aspart). Você pode injetar de 1 a 80 unidades em uma única injeção. As unidades podem ser aumentadas em 1 unidade por vez.
- As pessoas que são cegas ou têm problemas de visão não devem usar a caneta sem a ajuda de uma pessoa treinada para usar a caneta.
- Não Use uma seringa para remover o Fiasp da caneta FlexTouch.
Suprimentos que você precisará para dar sua injeção de fiasp:
- FIASP FlexTouch Pen
- Uma nova Novafina Novofine Plus ou Novotwist Needle
- álcool swab
- Um recipiente de pontas pontuais para jogar fora canetas e agulhas usadas. Ver Após sua injeção no final dessas instruções.
Preparando sua caneta Fiasp Flextouch:
- Lave as mãos com água e sabão.
- Antes de começar a preparar sua injeção, verifique o rótulo FIASP FLEXTOUCH PEN para garantir que você esteja tomando o tipo certo de insulina. Isso é especialmente importante se você tomar mais de um tipo de insulina.
- FIASP should look clear e colorless. Não Use fiasp se estiver espesso nublado ou colorido.
- Não Use Fiasp após a data de vencimento impressa no rótulo ou 28 dias após o início do uso da caneta.
- Sempre Use uma nova agulha para cada injeção para ajudar a garantir a esterilidade e evitar agulhas bloqueadas. Não reutilizar ou compartilhar agulhas com outra pessoa. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
Figura a
 |
Etapa 1:
- Puxe a tampa da caneta direto (veja a Figura B).
Figura b
 |
Etapa 2:
- Verifique o líquido na caneta (Veja a Figura C). Fiasp deve parecer claro e incolor. Não Use -o se parecer nublado ou colorido.
Figura c
 |
Etapa 3:
- Selecione uma nova agulha.
- Retire a guia de papel da tampa da agulha externa (veja a Figura D).
Figura d
 |
Etapa 4:
- Empurre a agulha tapada direto na caneta e torça a agulha até ficar apertada (veja a Figura E)
Figura e
 |
Etapa 5:
- Retire a tampa da agulha externa. Não Jogue fora (veja a Figura F).
Figura F.
 |
Etapa 6:
- Retire a tampa da agulha interna e jogue -a fora (veja a Figura G).
Figura g
 |
Printando sua caneta fiasp flextoch:
Etapa 7:
- Gire o seletor de dose para selecionar 2 unidades (consulte a Figura H).
Figura H.
 |
Etapa 8:
- Segure a caneta com a agulha apontando para cima. Toque na parte superior da caneta gentilmente algumas vezes para deixar as bolhas de ar subirem até o topo (veja a Figura I).
Figura I.
 |
Etapa 9:
- Segure a caneta com a agulha apontando para cima. Pressione e segure o botão de dose até que o contador da dose mostre 0. O 0 deve alinhar com o ponteiro da dose.
- Uma gota de insulina deve ser vista na ponta da agulha (veja a Figura J).
- Se você não Veja uma gota de insulina Repita as etapas 7 a 9 não mais que 6 vezes.
- Se você ainda não Veja uma gota de insulina trocar a agulha e repita as etapas 7 a 9.
Figura j
 |
Selecionando sua dose:
Etapa 10:
Verifique se o seletor de dose está definido em 0.
- Gire o seletor de dose para selecionar o número de unidades que você precisa injetar. O ponteiro da dose deve alinhar -se com a sua dose (veja a Figura K).
- Se você select the wrong dose you can turn the dose selector forwards or backwards to the correct dose.
- Os números pares são impressos no mostrador.
- Os números ímpares são mostrados como linhas.
Figura k
 |
- A escala de insulina Fiasp Flextouch Pen mostrará quanto insulina é deixada na sua caneta (veja a Figura L).
Figura L.
 |
- Para ver quanta insulina é deixada na sua caneta Fiasp Flextoch:
- Gire o seletor da dose até que ele pare. O contador de dose se alinhará com o número de unidades de insulina que é deixada na sua caneta. Se o contador da dose mostrar 80 restarem pelo menos 80 unidades na sua caneta.
- Se o contador de dose mostrar menos de 80, o número mostrado no contador de dose é o número de unidades deixadas na sua caneta.
Dando sua injeção:
- Injete seu fiasp exatamente como seu provedor de saúde mostrou a você. Seu provedor de saúde deve dizer se você precisa beliscar a pele antes de injetar.
- Você deve tomar a dose de fiasp no início de uma refeição ou dentro de 20 minutos após o início de uma refeição.
- FIASP can be injected under the skin (subcutaneously) of your stomach area (abdomen) upper legs (thighs) or upper arms. Não inject FIASP into your muscle.
- Altere (gire) seus locais de injeção dentro da área que você escolher para cada dose para reduzir o risco de obter lipodistrofia (poços na pele ou pele espessada) e amiloidose cutânea localizada (pele com pedaços) nos locais de injeção. Não use o mesmo local de injeção para cada injeção. Não injete onde a pele tem os poços está espessada ou tem nódulos. Não injete onde a pele está machucada tenra escamosa ou dura ou em cicatrizes ou pele danificada.
Etapa 11:
Escolha o seu local de injeção (braços ou abdômen das coxas) e limpe a pele com um cotonete de álcool. Deixe o local da injeção secar antes de injetar sua dose (veja a Figura M).
Figura m
 |
Etapa 12:
- Insira a agulha em sua pele (Veja a Figura N).
- Certifique -se de ver o contador de dose. Não cubra -o com os dedos; Isso pode parar sua injeção.
Figura n
 |
Etapa 13:
- Pressione e mantenha pressionado o botão da dose até que o contador da dose mostre 0 (Veja a Figura O).
Figura o
 |
- O 0 deve alinhar -se com o ponteiro da dose. Você pode então ouvir ou sentir um clique.
- Mantenha a agulha em sua pele depois O contador de dose retornou para 0 e conta lentamente para 6 (veja a Figura P).
Figura p
 |
- Quando o contador de dose retornar a 0, você não receberá sua dose completa até 6 segundos depois.
- Se a agulha for removida antes de contar para 6, você poderá ver um fluxo de insulina proveniente da ponta da agulha.
- Se você see a stream of insulin coming from the needle tip you will not get your full dose. If this happens you should check your blood sugar levels more often because you may need more insulin.
Etapa 14:
- Puxe a agulha para fora da sua pele (Veja a Figura Q).
- Se você see blood after you take the needle out of your skin press the injection site lightly with a piece of gauze or an álcool swab. Não rub the area.
Figura q
 |
Etapa 15:
- Remova cuidadosamente a agulha da caneta e jogue -a fora (Veja a Figura R).
Figura r
 |
- Não recapitular a agulha. Recapitular a agulha pode levar a lesões por bastão de agulha.
- Se você não Tenha um recipiente pontiagudo com cuidado a agulha na tampa da agulha externa (veja a Figura S). Remova a agulha com segurança e jogue -a fora o mais rápido possível.
Figura S.
 |
- Não Armazene a caneta com a agulha presa. O armazenamento sem a agulha preso ajuda a evitar o vazamento de bloqueio da agulha e do ar de entrar na caneta.
Etapa 16:
- Substitua a tampa da caneta pressionando -a direta (veja a Figura T).
Figura T.
 |
Após sua injeção:
- Coloque suas agulhas usadas em um contêiner de descarte da FDA Cleared Sharps imediatamente após o uso. Não jogue fora (descarte) agulhas soltas em seu lixo doméstico.
- Se você não have a FDA-cleared sharps disposal container you may use a household container that is:
- feito de um plástico pesado
- pode ser fechado com uma tampa resistente à punção apertada sem que sejam capazes de ser capazes de sair
- vertical e estável durante o uso
- resistente a vazamentos
- devidamente rotulado para alertar sobre resíduos perigosos dentro do recipiente
- Quando o seu contêiner de descarte da SHOTS estiver quase cheio, você precisará seguir as diretrizes da sua comunidade para o caminho certo para descartar o recipiente de descarte do seu Sharps. Pode haver leis estaduais ou locais sobre como você deve jogar fora agulhas e seringas usadas. Não reutilize ou compartilhe agulhas ou seringas com outra pessoa. Para obter mais informações sobre o descarte seguro da Staf Sharps e para obter informações específicas sobre o descarte dos própriosses no estado em que você mora no site da FDA em: https://www.fda.gov/safesharpsdisposal.
- Não dispose of your used sharps disposal container in your household trash unless your community guidelines permit this. Não recycle your used sharps disposal container.
Como devo armazenar minha caneta fiasp flextoch?
Antes do uso:
- Armazene as canetas Fiasp Fiasp não utilizadas na geladeira a 36 ° F a 46 ° F (2 ° C a 8 ° C) ou à temperatura ambiente abaixo de 86 ° F (30 ° C).
- Não congelamento fiasp. Não Use fiasp se estiver congelado.
- As canetas não utilizadas podem ser usadas até a data de validade impressa na etiqueta se mantida na geladeira.
- Se as canetas fiasp flextoch forem armazenadas à temperatura ambiente antes de usá -la primeiro, deve ser usada ou jogada fora dentro de 28 dias.
Caneta em uso:
- Armazene a caneta que você está usando atualmente sem a agulha conectada à temperatura ambiente abaixo de 30 ° C (86 ° F) ou na geladeira a 3 a 8 ° C a 46 ° F (2 ° C) por até 28 dias.
- Mantenha o fiasp longe de calor ou luz excessiva.
- A caneta Fiasp Flextoch que você está usando deve ser jogada fora após 28 dias, mesmo que ainda tenha insulina e a data de validade não tenha passado.
Informações gerais sobre o uso seguro e eficaz do FIASP:
- Mantenha canetas e agulhas fiasp flextoch fora do alcance das crianças.
- Sempre Use uma nova agulha para cada injeção.
- Não Compartilhe canetas ou agulhas fiasp flextoch com outras pessoas. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
Instruções para uso
FIASP®
[Fee 'ASP] injeção de Penfill® (insulina aspart) para uso subcutâneo de 3 ml de cartucho: 100 unidades/ml (U-100)
- Não share your PenFill cartridge or PenFill cartridge compatible insulin delivery device with other people even if the needle has been changed. You may give other people a serious infection or get a serious infection from them.
- Seu médico deve mostrar a você ou a seu cuidador como injetar o Fiasp da maneira certa antes de injetar -o pela primeira vez.
- FIASP PenFill cartridge 100 units/mL is a prefilled single-patient-use cartridge contendo 300 unidades de injeção de fiasp U-100 (insulina aspart).
- Depois de inserir o cartucho Penfill no seu dispositivo, você pode usá -lo para várias injeções. Leia o manual de instruções que acompanha seu dispositivo de entrega de insulina para obter instruções completas sobre como usar o cartucho Penfill com o dispositivo.
- Este cartucho Penfill não é recomendado para uso pelos cegos ou com deficiência visual sem a assistência de uma pessoa treinada no uso adequado do produto e no seu dispositivo de entrega de insulina.
- Se estiver usando um novo cartucho de Penfill Fiasp, inicie com a etapa 1.
- Se o cartucho Penfill FIAsp já tiver sido usado, inicie com a etapa 2.
Suprimentos que você precisará para dar sua injeção de fiasp:
- FIASP PenFill cartridge
- Novo Nordisk 3 ml Penfill Cartuck
- 1 novo Novofine® Novofine® Plus ou Novotwist® Needle
- Swab do álcool
- Bandagem adesiva
- Gaze de algodão
- Um recipiente para o SHOTS para jogar fora cartuchos e agulhas usados. Ver Após sua injeção No final dessas instruções.
Figura a
 |
Como usar o cartucho Fiasp Penfill
- Lave as mãos com água e sabão.
- Antes de começar a preparar sua injeção Verifique a etiqueta do cartucho Fiasp Penfill Para garantir que ele contenha a insulina que você precisa. Isso é especialmente importante se você tomar mais de um tipo de insulina.
- A folha resistente a adulteração deve estar em vigor antes do primeiro uso. Se a folha tiver sido quebrada ou removida antes do primeiro uso do cartucho, não o use. Ligue para Novo Nordisk em 1-800-727-6500.
- Olhe cuidadosamente para o cartucho e a insulina dentro dele. Verifique se o cartucho FIASP:
- não está danificado, por exemplo, rachado ou vazando
- não está solto na extremidade encadeada
- FIASP should look clear e colorless. Não Use fiasp se estiver nublado ou colorido ou se a extremidade rosqueada estiver solta (veja a Figura B).
Figura b
 |
Etapa 1:
- Insira um cartucho de 3 ml com a extremidade rosqueada primeiro no seu dispositivo de entrega de insulina compatível com Nordisk 3 Ml de Penfill (consulte a Figura C).
- Se você drop your device check the insulin cartridge for damage such as cracks or leaking. Se vocêr cartridge is damaged throw it away e use a new one.
Figura c
 |
Prepare seu dispositivo com uma nova agulha
Etapa 2:
- Pegue uma nova agulha e tear off the paper tab. Sempre use a new needle for each injection to make sure the needle is free of germs (sterile) e to prevent blocked needles. Não attach a new needle para o seu dispositivo até que você esteja pronto para dar sua injeção. Não reuse or share your needles with other people. You may give others a serious infection or get a serious infection from them.
- Cuidado para não dobrar ou danificar a agulha antes de usá -la.
- Empurre a agulha direto para o dispositivo. Gire a agulha no sentido horário até que esteja apertada (veja a Figura D).
Figura d
 |
Etapa 3:
- Retire a tampa da agulha externa (Veja a Figura E). Não jogue fora. Você precisará disso após a injeção para remover a agulha com segurança.
Figura e
 |
Etapa 4:
- Retire a tampa da agulha interna e Jogue fora (veja a Figura F). Não Tente colocar a tampa da agulha interna de volta na agulha.
Figura F.
 |
Uma gota de insulina pode aparecer na ponta da agulha. Isso é normal, mas você ainda deve verificar o fluxo de insulina.
Verifique o fluxo de insulina
Etapa 5:
- Pequenas quantidades de ar podem coletar no cartucho durante o uso normal. Você deve fazer um tiro no ar antes de cada injeção para evitar a injeção de ar e para garantir que você receba a dose prescrita do seu medicamento.
- Faça o tiro aéreo, conforme descrito no manual de instruções que acompanha seu dispositivo.
- Continue testando seu dispositivo de entrega de insulina compatível com cartucho de 3 ml de Nordisk 3 ml até ver a insulina na ponta da agulha. Se você ainda não vir uma gota de insulina após 6 vezes, mude a agulha e repita esta etapa. Isso garante que quaisquer bolhas de ar sejam removidas e que a insulina esteja atravessando a agulha (veja a Figura G).
Figura g
 |
Selecione sua dose
Etapa 6:
- Verifique se o contador de dose está definido como 0.
- Gire o seletor de dose no sentido horário para selecionar a dose necessária para injetar (Veja a Figura H). O ponteiro deve alinhar -se com sua dose. Ao girar o seletor de dose, tenha cuidado para não pressionar o botão de dose, pois a insulina será lançada. Você ouvirá um clique para cada unidade discada. Não Defina a dose contando o número de cliques que você ouve, porque você pode obter uma dose incorreta.
- Consulte o manual do dispositivo de entrega de insulina, se necessário.
Figura H.
 |
Injete sua dose
Etapa 7:
- Faça a injeção exatamente como mostrado por seu provedor de saúde. Seu provedor de saúde deve dizer se você precisa beliscar a pele antes de injetar.
- Você deve tomar a dose de fiasp no início de uma refeição ou dentro de 20 minutos após o início de uma refeição.
- FIASP can be injected under the skin (subcutaneously) of your stomach area (abdomen) upper legs (thighs) or upper arms (See Figura I.).
Figura I.
 |
- Altere (gire) seus locais de injeção dentro da área que você escolher para cada dose para reduzir o risco de obter lipodistrofia (poços na pele ou pele espessada) e amiloidose cutânea localizada (pele com pedaços) nos locais de injeção. Não use o mesmo local de injeção para cada injeção. Não injete onde a pele tem os poços está espessada ou tem nódulos. Não injete onde a pele está machucada tenra escamosa ou dura ou em cicatrizes ou pele danificada.
- Limpe seu local de injeção com um cotonete de álcool. Deixe sua pele secar. Não toque nessa área novamente antes de injetar.
- Insira a agulha em sua pele. Pressione e mantenha pressionado o botão da dose até que o contador da dose mostre 0. Continue to keep the dose button pressed e keep the needle in your skin e slowly count to 6 (see Figura j).
- Retire a agulha da sua pele.
Figura j
 |
Você pode ver uma gota de fiasp na ponta da agulha após a injeção. Isso é normal e não tem efeito na dose que você acabou de receber. Se o sangue aparecer depois de tirar a agulha da pele, pressione levemente o local da injeção com uma gaze de algodão e cubra com um curativo adesivo, se necessário. Não esfregue a área.
Após sua injeção
Etapa 8:
- Coloque a tampa da agulha externa em uma superfície plana. Lidera cuidadosamente a ponta da agulha para a tampa da agulha externa sem tocar a agulha (veja a Figura K) e empurre completamente a tampa da agulha externa.
Figura k
 |
- Segure o suporte do cartucho preto no dispositivo de entrega de insulina e desaparafuse a agulha no sentido anti -horário (veja a Figura L). Titular do cartucho
Figura L.
 |
- Jogue fora (descarte) a agulha em um contêiner da FDA Cleared Sharps, pois seu profissional de saúde o instruiu.
- Coloque seu cartucho de Penfill Fiasp vazio e use agulhas em um contêiner de descarte de pontas de ponta da FDA imediatamente após o uso. Não jogue fora (descarte) agulhas soltas e cartuchos de preenchimento em seu lixo doméstico.
- Se você não have a FDA-cleared sharps disposal container you may use a household container that is:
- feito de um plástico pesado
- pode ser fechado com uma tampa resistente à punção apertada sem que sejam capazes de ser capazes de sair
- vertical e estável durante o uso
- resistente a vazamentos
- devidamente rotulado para alertar sobre resíduos perigosos dentro do recipiente
- Quando o seu contêiner de descarte da SHOTS estiver quase cheio, você precisará seguir as diretrizes da sua comunidade para o caminho certo para descartar o recipiente de descarte do seu Sharps. Pode haver leis estaduais ou locais sobre como você deve jogar fora agulhas e seringas usadas. Não reutilize ou compartilhe suas agulhas ou seringas com outras pessoas. Para obter mais informações sobre o descarte seguro da SAFTS e para obter informações específicas sobre o descarte do Estado em que você mora no site da FDA em: https://www.fda.gov/safesharpsdisposal.
- Não dispose of your used sharps disposal container in your household trash unless your community guidelines permit this. Não recycle your used sharps disposal container.
Etapa 9:
- Mantenha o cartucho Penfill de 3 ml no dispositivo. Não guarde seu dispositivo com uma agulha presa. Isso impedirá a infecção ou vazamento de insulina e garantirá a dose certa de fiasp.
- Coloque a tampa da caneta Seu dispositivo após cada uso para proteger a insulina da luz (consulte a Figura M).
Figura m
 |
Como devo armazenar meu cartucho Penfill fiasp?
Antes do uso:
- Armazene os cartuchos de penfill fiasp não utilizados na geladeira a 3 a 46 ° C (2 ° C a 8 ° C).
- Não congelamento fiasp. Não Use fiasp se estiver congelado.
- Os cartuchos de Penfill não utilizados podem ser usados até a data de validade impressa no rótulo, se mantida na geladeira.
- Se fiasp for armazenado erroneamente fora da refrigeração entre 9 ° C (47 ° F) a 86 ° F (30 ° C) antes do primeiro uso, deve ser usado dentro de 28 dias ou jogado fora.
Cartuchos de Penfill em uso:
- Armazene o cartucho Penfill que você está usando atualmente no dispositivo de entrega de insulina à temperatura ambiente abaixo de 30 ° C (86 ° C) por até 28 dias. Não refrigerar.
- Mantenha Fiasp longe do calor ou da luz.
- O cartucho Penfill Fiasp que você está usando deve ser jogado fora após 28 dias, mesmo que ainda tenha insulina nele.
Informações gerais sobre o uso seguro e eficaz do fiasp.
- Mantenha os cartuchos e agulhas do Penfill fiasp fora do alcance das crianças.
- Não Compartilhe cartuchos ou agulhas de Penfill Fiasp com outras pessoas. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
- Sempre carry extra insulin of the same type(s) you use in case of loss or damage.
Instruções para uso
FIASP®
[Fee € ™ ASP] Injeção de PumpCart® (insulina aspart) para uso subcutâneo1,6 ml de cartucho: 100 unidades/ml (U-100)
- Leia o manual da bomba (guia do usuário) que vem com sua bomba de insulina.
- Use apenas a bomba fiasp com uma bomba de insulina compatível. Verifique o manual da bomba de insulina para obter instruções para ver se o FIASP Pumpcart pode ser usado com a bomba. Não use com outros dispositivos que não foram projetados para uso com o FIASP Pumpcart.
- FIASP PumpCart is ready for use directly in the pump. Using the wrong device may result in the wrong insulin dosing e lead to Alto açúcar no sangue (Hiperglicemia) ou baixo açúcar no sangue (hipoglicemia).
- Não share your PumpCart cartridge with other people. You may give other people a serious infection or get a serious infection from them.
- Não use the PumpCart cartridge if you are blind or visually impaired without the assistance of a person trained in the proper use of the PumpCart.
- Não mix with any other insulins.
- Não refill FIASP PumpCart. When it is empty throw away (dispose) the cartridge.
- Não use FIASP PumpCart in an insulin pen.
Preparando e usando o cartucho FIAsp Pumpcart
- Tire o Fiasp Pumpcart de sua embalagem.
- Verifique a etiqueta para garantir que seja FIASP Pumpcart e confirme que está usando uma bomba de insulina compatível.
- Verifique a data de validade (exp) - que está no rótulo e na caixa.
- Veja a figura A. Não use the cartridge Se algum dano ou vazamento for visto se o êmbolo tiver movido ou se a parte inferior do êmbolo estiver visível acima da faixa de etiqueta branca. Isso pode ser resultado do vazamento de insulina. Entre em contato com o Novo Nordisk se você suspeitar que seu cartucho Fiasp Pumpcart está danificado.
- Verifique se a insulina no FIASP Pumpcart é clara e incolor. Se a insulina parecer nublada, não use FIASP Pumpcart. O cartucho pode conter pequenas bolhas.
- Lave as mãos com água e sabão antes de instalar o cartucho na bomba de insulina.
- Siga as instruções no manual do usuário da bomba para inserir um novo cartucho FIASP Pumpcart na sua bomba e remover o cartucho FIASP Pumpcart da sua bomba.
- Substitua o cartucho FIASP Pumpcart pelo menos a cada 4 dias ou de acordo com o manual do usuário da bomba, o que for mais curto, mesmo que você não tenha usado toda a insulina.
- Altere os conjuntos de infusão e o local de inserção do conjunto de infusão de acordo com o manual do usuário dos fabricantes de bombas de insulina.
- Jogue fora a bomba fiasp no reservatório da bomba se tiver sido exposto a temperaturas superiores a 98,6 ° F (37 ° C).
Como devo descartar meu cartucho de bomba fiasp?
- Coloque o seu bombeamento de bomba fiasp vazio em um contêiner de descarte da FDA Cleared Sharps imediatamente após o uso. Não jogue fora (descarte de) Fiasp Pumpcart no lixo da sua casa.
- Se você não have a FDA-cleared sharps disposal container you may use a household container that is:
- feito de um plástico pesado
- pode ser fechado com uma tampa resistente à punção apertada sem que sejam capazes de ser capazes de sair
- vertical e estável durante o uso
- resistente a vazamentos
- devidamente rotulado para alertar sobre resíduos perigosos dentro do recipiente
- Quando o seu contêiner de descarte da SHOTS estiver quase cheio, você precisará seguir as diretrizes da sua comunidade para o caminho certo para descartar o recipiente de descarte do seu Sharps. Pode haver leis estaduais ou locais sobre como você deve jogar fora agulhas e seringas usadas. Para obter mais informações sobre o descarte seguro dos próprios protetores e para obter informações específicas sobre o descarte dos próprios cortes no estado em que você mora, acesse o site da FDA em: https://www.fda.gov/safesharpsdisposal.Não descarte seu recipiente de descarte usado em sua comunidade, a menos que as diretoras da comunidade. Não recicle o seu recipiente de descarte de pontas pontuais usadas.
Como devo armazenar meu cartucho FIASP Pumpcart?
- Não em uso (fechado) cartridges: Refrigerate at 36°F to 46°F (2°C to 8°C) in the original carton until expiration or for up to 18 days below 86°F (30°C).
- Em uso (aberto) cartridge: Não refrigerar. Keep below 98.6°F (37°C) for up to 4 days. The maximum time at room temperature is 18 days including 4 days in the pump.
- Não freeze.
- Mantenha o cartucho Fiasp Pumpcart longe do calor ou da luz.
Informações gerais sobre o uso seguro e eficaz do cartucho de bombeamento FIASP
- Mantenha o Fiasp Pumpcart fora do alcance das crianças.
- Sempre carry extra insulin of the same type you use in case of loss or damage.
Instruções para uso
FIASP
(Fee 'ASP) (INSULIN ASPART) Injeção de 10 ml de frasco de dose múltipla (100 unidades/ml U-100)
Leia essas instruções para uso antes de começar a tomar fiasp e cada vez que você recebe um refil. Pode haver novas informações. Esta informação não substitui o seu provedor de saúde sobre sua condição médica ou seu tratamento. O frasco não é recomendado para uso pelos cegos ou com deficiência visual sem a assistência de uma pessoa treinada no uso adequado do produto e na seringa de insulina.
Não reutilizar ou compartilhar seringas ou agulhas com outras pessoas. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
Suprimentos que você precisará para dar sua injeção de fiasp:
- um frasco de 10 ml fiasp
- uma seringa e agulha de insulina sub-100
- 2 swabs de álcool
- 1 recipiente de pontas para jogar fora agulhas e seringas usadas. Veja a descarte de suas agulhas e seringas usadas no final dessas instruções.
Preparando sua dose fiasp:
- Não Enrole ou agite o frasco fiasp. Agitar o frasco fiasp logo antes da dose ser desenhada na seringa pode causar bolhas ou espuma. Isso pode fazer com que você elabore a dose errada de insulina.
- A tampa resistente a adulteração não deve ser solta ou danificada antes do primeiro uso. Não use se a tampa resistente a adulteração estiver solta ou danificada antes de usar o FIASP pela primeira vez.
- Lave as mãos com água e sabão.
- Antes de começar a preparar sua injeção check the FIASP label to make sure that you are taking the right type of insulin. This is especially important if you use more than 1 type of insulin.
- Verifique se o frasco fiasp não está rachado ou danificado. Não Use se o frasco fiasp estiver rachado ou danificado.
- FIASP should look clear e colorless. Não Use fiasp se estiver espesso nublado ou colorido.
- Não Use fiasp após a data de validade impressa no rótulo.
Etapa 1: Tire a tampa resistente a adulteração (veja a Figura A). Etapa 2: Limpe a rolha de borracha com um cotonete de álcool (veja a Figura B).
Figura a e Figura b
Etapa 3: Segure a seringa com a agulha apontando para cima. Puxe para baixo no êmbolo até que a ponta do êmbolo atinja a linha para o número de unidades para a dose prescrita (veja a Figura C).
Figura c
Etapa 4: Empurre a agulha através da rolha de borracha do Fiasp frasco (veja a Figura D).
Figura d
Etapa 5: Empurre o êmbolo todo o caminho. Isso coloca o ar no frasco fiasp (veja a Figura E).
Figura e
Etapa 6: Gire o frasco fiasp e a seringa de cabeça para baixo e puxe lentamente o êmbolo para baixo até que a ponta do êmbolo esteja algumas unidades além da linha para a sua dose (veja a Figura F). Se houver bolhas de ar, toque na seringa suavemente algumas vezes para deixar as bolhas de ar subirem ao topo (veja a Figura G).
Figura F.
Figura g
Etapa 7: Empurre lentamente o êmbolo para cima até que a ponta do êmbolo atinja a linha para a dose fiasp prescrita (veja a Figura H).
Figura H.
Etapa 8: Verifique a seringa para garantir que você tenha a dose certa de fiasp.
Etapa 9: Puxe a seringa para fora da rolha de borracha no frasco (veja a Figura I).
Figura I.
Dando sua injeção de fiasp:
- Injete seu fiasp exatamente como seu provedor de saúde mostrou a você. Seu provedor de saúde deve dizer se você precisa beliscar a pele antes de injetar.
- Você deve tomar a dose de fiasp no início de uma refeição ou dentro de 20 minutos após o início de uma refeição.
- FIASP can be injected under the skin (subcutaneously) of your stomach area upper legs or upper arms infused in an insulin pump into an area of your body recommended in the instructions that come with your insulin pump or given through a needle in your arm (intravenously) by your healthcare provider. Não inject FIASP into your muscle.
- Se você use FIASP in an insulin pump you should change the infusion sets e the infusion set insertion site according to the pump manufacturers’ user manual. The insulin in the reservoir should be changed at least every 6 days even if you have not used all of the insulin.
- Se você use FIASP in an insulin pump see your insulin pump manual for instructions or talk to your healthcare provider. Your healthcare provider should provide recommendations for appropriate basal e meal time infusion rates.
- Altere (gire) seus locais de injeção dentro da área que você escolher para cada dose para reduzir o risco de obter lipodistrofia (poços na pele ou pele espessada) e amiloidose cutânea localizada (pele com pedaços) nos locais de injeção. Não Use o mesmo local de injeção para cada injeção. Não Injetar onde a pele tem poços está espessada ou tem nódulos. Não Injete onde a pele está machucada tenra escamosa ou dura ou em cicatrizes ou pele danificada.
- Não Dilua ou misture fiasp com qualquer outro tipo de produto ou soluções de insulina.
Etapa 10: Escolha o seu local de injeção (braços das coxas ou abdômen) e limpe a pele com um cotonete de álcool (veja a Figura J). Deixe o local da injeção secar antes de injetar sua dose.
Figura j
Etapa 11: Insira a agulha em sua pele. Push down on the plunger to inject your dose (See Figura k).
Certifique -se de injetar toda a insulina na seringa.
Figura k
Etapa 12: Puxe a agulha para fora da sua pele. Após sua injeção you may see a drop of FIASP at the needle tip. This is normal e does not affect the dose you just received (See Figura L.).
- Se você see blood after you take the needle out of your skin press the injection site lightly with a piece of gauze or an álcool swab. Não rub the area.
Figura L.
Após sua injeção:
- Não recapitular a agulha. Recapitular a agulha pode levar a lesões por bastão de agulha.
Descartando suas agulhas e seringas usadas:
Coloque suas agulhas e seringas de insulina usadas em um contêiner de descarte de pontas pontiagudas da FDA imediatamente após o uso. Não jogue fora (descarte) agulhas e seringas soltas no lixo da sua casa.
Se você não have a FDA-cleared sharps disposal container you may use a household container that is:
- feito de um plástico pesado;
- pode ser fechado com uma tampa resistente à punção apertada sem que sejam capazes de ser capazes de sair;
- vertical e estável durante o uso;
- resistente a vazamentos e
- devidamente rotulado para alertar sobre resíduos perigosos dentro do recipiente.
- Quando o seu contêiner de descarte da SHOTS estiver quase cheio, você precisará seguir as diretrizes da sua comunidade para o caminho certo para descartar o recipiente de descarte do seu Sharps. Pode haver leis estaduais ou locais sobre como você deve jogar fora agulhas e seringas usadas. Não reutilize ou compartilhe agulhas ou seringas com outra pessoa. Para obter mais informações sobre o descarte seguro da Staf Sharps e para obter informações específicas sobre o descarte dos própriosses no estado em que você mora no site da FDA em: https://www.fda.gov/safesharpsdisposal.
- Não dispose of your used sharps disposal container in your household trash unless your community guidelines permit this. Não recycle your used sharps disposal container.
Como devo armazenar fiasp?
- Não congelamento fiasp. Não Use fiasp se estiver congelado.
- Mantenha o fiasp longe de calor ou luz excessiva.
Todos os frascos fechados:
- Armazene os frascos fiasp fechados na geladeira a 36 ° F a 46 ° F (2 ° C a 8 ° C) ou à temperatura ambiente abaixo de 86 ° F (30 ° C).
- Se os frascos não abertos tiverem sido armazenados nos frascos de geladeira, podem ser usados até a data de validade impressa no rótulo.
- Se os frascos não abertos tiverem sido armazenados em frascos à temperatura ambiente, devem ser jogados fora após 28 dias.
Depois que os frascos foram abertos:
- Os frascos FIAsp abertos podem ser armazenados na geladeira a 36 ° C a 46 ° F (2 ° C a 8 ° C) ou à temperatura ambiente abaixo de 86 ° F (30 ° C).
- Jogue fora todos os frascos FIAsp abertos após 28 dias (incluindo 6 dias de tempo de bomba em uso), mesmo que ainda tenham insulina neles.
Informações gerais sobre o uso seguro e eficaz de fiasp
- Sempre use a new syringe e needle for each injection to help ensure sterility e prevent blocked needles.
- Não reutilizar ou compartilhar seringas ou agulhas com outras pessoas. Você pode dar a outras pessoas uma infecção grave ou obter uma infecção grave delas.
- Mantenha as seringas e as agulhas dos Fiasp Frials fora do alcance das crianças.
Essas instruções de uso foram aprovadas pela Food and Drug Administration dos EUA.